Melioidosis
Melioidosis adalah penyakit infeksi yang disebabkan oleh bakteri Gram-negatif bernama Burkholderia pseudomallei.[1] Kebanyakan orang yang dijangkiti Burkholderia pseudomallei tidak mengalami satupun gejala, tetapi mereka yang mengalami gejala memiliki tanda dan gejala dari gejala ringan seperti demam, perubahan kulit, radang paru-paru, dan bisul, hingga gejala berat seperti radang otak, radang sendi, dan tekanan darah rendah yang berbahaya yang menyebabkan kematian.[1] Sekitar 10% dari orang penderita melioidosis mengalami gejala yang berlangsung lebih dari dua bulan yang disebut melioidosis kronis.[1]
| Melioidosis | |
|---|---|
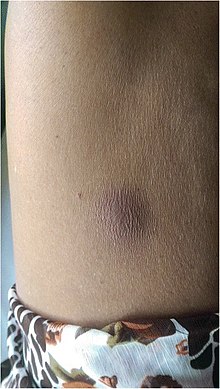 | |
| Bisul melioidosis di perut | |
| Informasi umum | |
| Spesialisasi | Penyakit menular |
| Penyebab | Burkholderia pseudomallei spread by contact to soil or water[1] |
| Faktor risiko | Diabetes mellitus, thalassaemia, alcoholism, chronic kidney disease[1] |
| Aspek klinis | |
| Gejala dan tanda | Tiada, demam, radang paru-paru, beberapa bisul[1] |
| Komplikasi | Encephalomyelitis, septic shock, acute pyelonephritis, septic arthritis, osteomyelitis[1] |
| Awal muncul | 1-21 hari setelah terjangkit[1] |
| Diagnosis | Mengembangkan bakteri di perantara kultur[1] |
| Kondisi serupa | Tuberculosis[2] |
| Tata laksana | |
| Pencegahan | Mencegah dari kontak dengan air yang terkontaminasi, profilaksis antibiotik[1] |
| Perawatan | Ceftazidime, meropenem, co-trimoxazole[1] |
| Distribusi dan frekuensi | |
| Prevalensi | 165,000 orang tiap tahun[1] |
| Kematian | 89,000 orang tiap tahunr[1] |
Manusia dijangkiti Burkholderia pseudomallei melalui kontak dengan air yang tercemar. Bakteri ini masuk ke dalam tubuh melalui luka, tarikan napas, atau penelanan. Penularan dari manusia ke manusia atau dari hewan ke manusia sangat jarang terjadi.[1] Infeksi ini masih ada di Asia Tenggara, khususnya di timur laut Thailand dan utara Australia.[1] Di negara-negara maju seperti Eropa dan Amerika Serikat, kasus melioidosis umumnya diimpor dari negara-negara tempat melioidosis lebih sering terjadi.[3] Tanda dan gejala melioidosis menyerupai tuberkulosis dan sering terjadi kesalahan diagnosis.[2][4] Diagnosis biasanya dikonfirmasi oleh pertumbuhan Burkholderia pseudomallei dari darah atau cairan tubuh orang yang dijangkiti lainnya.[1] Mereka yang menderita melioidosis pertama-tama diobati dengan antibiotik intravena "fase intensif" (paling sering seftazidima) diikuti dengan pengobatan kotrimoksazol selama beberapa bulan.[1] Bahkan jika dirawat dengan cermat, sekitar 10% penderita melioidosis meninggal karenanya. Jika tidak ditangani dengan cermat, tingkat kematian bisa melonjak hingga 40%.[1]
Upaya pencegahan melioidosis antara lain memakai alat pelindung diri saat menangani air yang terkontaminasi, membiasakan kebersihan tangan, minum air matang, dan menghindari kontak langsung dengan tanah, air, atau hujan lebat. Antibiotik kotrimoksazol hanya digunakan sebagai pencegahan untuk individu yang berisiko tinggi terkena melioidosis setelah terpapar bakteri. Tiada vaksin untuk melioidosis yang telah disetujui.[1]
Sekitar 165 ribu orang dijangkiti melioidosis tiap tahun dan menewaskan 89 ribu orang. Diabetes adalah faktor risiko utama penyakit melioidosis dengan lebih dari setengah kasus melioidosis terjadi pada penderita diabetes.[1] Peningkatan curah hujan dikaitkan dengan lonjakan jumlah kasus melioidosis di daerah endemi.[2] Melioidosis pertama kali dideskripsikan oleh Alfred Whitmore pada tahun 1912 di wilayah yang saat ini bernama Myanmar.[5]
Etimologi
suntingNama melioidosis berasal dari bahasa Yunani yaitu melis (μηλις) yang berarti "penyakit virus pada keledai" dengan akhiran -oid yang berarti "mirip dengan" dan -osis yang berarti "suatu keadaan", yaitu suatu keadaan yang mirip dengan glander.[6] Istilah melioidosis juga bersinonim dengan:
- Pseudoglander[7]
- Penyakit Whitmore (after Captain Alfred Whitmore, who first described the disease)[5]
- Nightcliff gardener's disease (Nightcliff is a suburb of Darwin, Australia where melioidosis is endemic)[8]
- Penyakit sawah[9]
- Morphia injector's septicaemia[10]
Tanda dan gejala
suntingAkut
suntingPajanan terhadap Burkholderia pseudomallei biasanya dapat menyebabkan antibodi diproduksi untuk melawan bakteri itu tanpa gejala apapun. Dari pasien yang menderita infeksi klinis, 85% pasien mengalami gejala akut dari pemerolehan bakteri terkini.[1][11][12] Masa inkubasi rata-rata melioidosis akut adalah 9 hari (kisaran 1–21 hari).[1] Walau begitu, gejala melioidosis dapat muncul dalam 24 jam bagi mereka yang dijangkiti saat hampir tenggelam di air yang terkontaminasi.[12] Mereka yang terkena melioidosis akan memunculkan gejala sepsis (terutama demam) dengan atau tanpa radang paru-paru, atau bisul atau fokus infeksi lainnya. Adanya tanda dan gejala yang tidak spesifik yang menyebabkan melioidosis dijuluki "peniru ulung".[1]
Orang yang menderita diabetes melitus atau pajanan bakteri secara teratur berada pada peningkatan risiko menderita melioidosis. Penyakit ini harus dipertimbangkan pada mereka yang tinggal di daerah endemi yang mengalami demam, radang paru-paru, atau bisul di hati, limpa, prostat, atau kelenjar parotid mereka. Manifestasi klinis penyakit ini dapat membentang dari perubahan kulit yang sederhana hingga masalah organ yang parah.[1] Perubahan kulit dapat berupa bisul atau tukak nonspesifik.[13] Di utara Australia, 60% dari anak-anak yang terjangkit hanya menunjukkan lesi kilit, sedangkan 20% dari anak-anak yang terjangkit menunjukkan radang paru-paru.[3] Organ yang paling sering terkena melioidosis adalah hati, limpa, paru-paru, prostat, dan ginjal. Di antara tanda-tanda klinis yang paling umum adalah adanya bakteri dalam darah (dalam 40% sampai 60% kasus), radang paru-paru (50%), dan syok septik (20%).[1] Orang yang hanya mengalami radang paru-paru pneumonia mungkin mengalami batuk yang menonjol dengan dahak dan sesak napas. Namun, mereka yang mengalami syok septik bersama dengan radang paru-paru mungkin mengalami batuk yang minimal.[2] Hasil sinar-X dada dapat membentang dari infiltrat nodular difus pada mereka yang mengalami syok septik hingga pemadatan paru-paru progresif di lobus atas pada mereka yang hanya mengalami radang paru-paru. Kelebihan cairan di rongga pleura dan pengumpulan nanah di dalam rongga lebih sering terjadi pada melioidosis yang memengaruhi lobus bawah paru-paru.[2] Dalam 10% kasus, orang menderita radang paru-paru sekunder yang disebabkan oleh bakteri lain setelah infeksi primer.[3]
Manifestasi parah lainnya terjadi bergantung pada perjalanan infeksi. Sekitar 1% hingga 5% dari mereka yang terjangkit mengalami radang otak dan penutup otak atau kumpulan nanah di otak, 14% hingga 28% mengalami peradangan bakteri pada ginjal, bisul ginjal atau bisul prostat, 0% sampai 30% mengalami bisul leher atau kelenjar ludah, 10% hingga 33% mengalami bisul hati, limpa, atau paraintestinal, dan 4% sampai 14% mengalami artritis septik dan osteomielitis.[1] Manifestasi yang langka di antaranya penyakit kelenjar getah bening yang menyerupai tuberkulosis,[14] massa mediastinum, pengumpulan cairan di penutup jantung,[3] dilatasi abnormal pembuluh darah karena infeksi,[1] dan radang pankreas.[3] Di Australia, hingga 20% dari pria yang terjangkit mengalami bisul prostat yang ditandai dengan nyeri saat buang air kecil, kesulitan buang air kecil, dan retensi urin yang memerlukan kateterisasi.[1] Pemeriksaan rektum menunjukkan peradangan prostat.[3] Di Thailand, 30% dari anak-anak yang terjangkit mengalami bisul parotid.[1] Ensefalomielitis dapat terjadi pada orang sehat tanpa faktor risiko. Mereka yang menderita ensefalomielitis melioidosis cenderung memiliki pindaian tomografi terkomputasi normal, tetapi sinyal T2 oleh pencitraan resonansi magnetik sehingga meluas ke batak otak dan sumsum tulang belakang. Tanda-tanda klinis yaitu kelemahan anggota gerak neuron motorik atas unilateral, tanda-tanda serebelar, dan kelumpuhan saraf kranial (kelumpuhan saraf VI, VII, dan kelumpuhan bulbar). Beberapa kasus hanya mengalami kelumpuhan kulai.[3] Di utara Australia, semua kasus melioidosis beserta ensefalomielitis mengalami peningkatan sel darah putih dalam cairan serebrospinal (CSF), sebagian besar sel mononuklir dengan protein CSF yang meningkat.[14]
Kronis
suntingMelioidosis kronis biasanya ditandai dengan gejala yang berlangsung lebih dari dua bulan dan terjadi pada sekitar 10% pesakit.[1] Penyajian klinis yaitu demam, penurunan berat badan, dan batuk berkelanjutan dengan atau tanpa dahak berdarah, yang mungkin menyerupai tuberkulosis. Selain itu, bisul di beberapa bagian tumbuh yang berlangsung lama juga dapat timbul.[2] Tuberkulosis harus diwaspadai jika kelenjar getah bening membesar di akar paru-paru. Melioidosis kronis dapat muncul dengan kavitasi radang paru-paru menyerupai tuberkulosis paru kronis.[4] Tidak seperti tuberkulosis, radang paru-paru yang disebabkan oleh melioidosis jarang menyebabkan jaringan parut dan pengapuran paru-paru, tidak seperti tuberkulosis.[14]
Laten
suntingDalam infeksi laten, orang yang imunokompeten dapat menghilangkan infeksi tanpa menunjukkan gejala apa pun, tetapi kurang dari 5% dari semua kasus melioidosis memiliki aktivasi setelah periode laten.[1] Pesakit melioidosis laten dapat saja bebas gejala selama beberapa dasawarsa.[15] Awalnya, periode terlama antara dugaan paparan dan presentasi klinis diperkirakan selama 62 tahun di tahanan perang Perang Dunia II di Burma-Thailand-Malaysia.[15] Genotipe isolat bakteri selanjutnya dari veteran Perang Vietnam menunjukkan bahwa isolat tersebut mungkin tidak berasal dari Asia Tenggara, melainkan Amerika Selatan.[16] Laporan ini membalikkan laporan lain yang menempatkan periode laten terpanjang untuk melioidosis yaitu 29 tahun.[17] Potensi inkubasi yang berkepanjangan diakui oleh prajurit Amerika Serikat yang terlibat dalam Perang Vietnam, sehingga melioidosis disebut sebagai "bom waktu Vietnam".[2][4] Di Australia, periode laten terpanjang yang tercatat adalah 24 tahun.[3] Berbagai komorbiditas seperti diabetes, gagal ginjal, dan alkoholisme dapat menjadi predisposisi reaktivasi melioidosis.[2]
Penyebab
suntingBakteri
suntingMelioidosis disebabkan oleh bakteri Gram-negatif, motil, saprofit bernama Burkholderia pseudomallei. Bakteri ini juga dapat menjadi patogen intraseluler fakultatif oportunistik.[1] Bakteri ini juga aerobik dan positif berdasarkan uji oksidase. Sebuah vakuola di tengah bakteri membuatnya menyerupai “peniti” saat diwarnai dengan Gram.[2] Bakteri ini mengeluarkan bau tanah yang kuat setelah 24 hingga 48 jam pertumbuhan dalam kultur. Burkholderia pseudomallei menghasilkan kapsul polisakarida glikokaliks yang membuatnya resisten terhadap banyak jenis antibiotik.[18] Bakteri ini umumnya resisten terhadap gentamisin dan kolistin, tetapi peka terhadap asam klavulanat (co-amoxiclav). Burkholderia pseudomallei adalah patogen level keselamatan biologi 3, yang memerlukan penanganan laboratorium khusus.[2] Pada hewan, makhluk hidup serupa lainnya bernama Burkholderia mallei adalah agen penyebab penyakit glanders.[1] Burkholderia pseudomallei dapat dibedakan dari Burkholderia thailandensis yang berkerabat dekat tetapi kurang patogen lewat kemampuannya mengasimilasi arabinose.[14] Burkholderia pseudomallei sangat mudah beradaptasi dengan berbagai lingkungan inang mulai dari spora jamur mikoriza hingga ameba.[2] Kemampuan beradaptasinya dapat memberikan keuntungan bertahan hidup dalam tubuh manusia.[1]
Genom Burkholderia pseudomallei terdiri dari dua replikon, yaitu kromosom 1 mengodekan fungsi urus rumah bakteri seperti sintesis, mobilitas, dan metabolisme dinding sel serta kromosom 2 mengodekan fungsi yang memungkinkan bakteri beradaptasi dengan berbagai lingkungan. Transfer gen horizontal di antara bakteri telah menghasilkan genom yang sangat bervariasi pada Burkholderia pseudomallei. Australia diperkirakan sebagai reservoir awal bagi Burkholderia pseudomallei karena variabilitas genetik yang tinggi dari bakteri yang ditemukan di wilayah ini. Bakteri yang diisolasi dari Afrika serta Amerika Tengah dan Selatan tampaknya memiliki nenek moyang sama yang hidup pada abad ke-17 hingga ke-19.[1] Burkholderia mallei adalah klon dari Burkholderia pseudomallei yang telah kehilangan sebagian besar genomnya karena beradaptasi untuk hidup secara eksklusif pada mamalia.[3]
Penularan
suntingBurkholderia pseudomallei biasanya ditemukan di tanah dan air permukaan serta paling banyak ditemukan di kedalaman tanah 10 cm hingga 90 cm.[1] Bakteri ini juga ditemukan di tanah, kolam, sungai, lubuk, genangan air, dan sawah.[2] Bakteri ini dapat bertahan hidup dalam lingkungan yang miskin nutrisi seperti air suling, tanah gurun, dan tanah yang kekurangan nutrisi selama lebih dari 16 tahun. Bakteri ini juga dapat bertahan dalam larutan antiseptik dan deterjen, lingkungan asam (pH 4,5 selama 70 hari), dan lingkungan pada suhu berkisar antara 24 °C hingga 32 °C. Bakteri ini tidak bertahan hidup dengan adanya sinar ultraviolet.[1]
Bakteri dapat memasuki tubuh lewat luka, hirupan, dan menelan air yang tercemar.[1] Penularan dari orang ke orang sangat jarang terjadi.[2] Melioidosis adalah penyakit yang diakui terhadap hewan semisal kucing, anjing, kambing, domba, dan kuda. Sapi, kerbau, dan buaya dianggap relatif resisten terhadap melioidosis meskipun terus-menerus terpapar air dan tanah yang mengandung bakteri ini. Burung juga resisten terhadap melioidosis.[14][18] Penularan dari hewan ke manusia jarang terjadi.[1][2]
Klorinasi pasokan air yang tidak memadai dikaitkan dengan wabah Burkholderia pseudomallei di Australia Utara dan Barat. Bakteri ini juga ditemukan dalam pasokan air yang tidak diklorinasi di pedesaan Thailand. Cairan pengairan yang terkontaminasi dengan Burkholderia pseudomallei dikaitkan dengan infeksi luka nosokomial di rumah sakit.[1] Berdasarkan pengurutan keseluruhan genom bakteri ini, manusia mungkin berperan dalam memindahkan Burkholderia pseudomallei dari satu tempat ke tempat lain.[19] Pada Oktober 2021, Pusat Pengendalian dan Pencegahan Penyakit Amerika Serikat mengonfirmasi wabah di Amerika Serikat yang dilacak dari semprotan aromaterapi yang diproduksi di India.[20]
Patogenesis
suntingBurkholderia pseudomallei memiliki kemampuan untuk menjangkiti pelbagai jenis sel dan menghindari respons imun manusia. Bakteri pertama-tama masuk ke dalam celah di kulit atau selaput lendir dan bereplikasi di sel epitel. Dari sana, bakteri ini menggunakan motilitas flagela untuk menyebar dan menjangkiti pelbagai jenis sel. Dalam aliran darah, bakteri ini dapat menjangkiti baik fagosit dan nonfagosit. Burkholderia pseudomallei menggunakan flagela untuk bergerak mendekati sel inang, kemudian menempel pada sel menggunakan pelbagai protein adhesi termasuk protein pilus tipe IV PilA dan protein adhesi BoaA dan BoaB. Selain itu, adhesi bakteri sebagian tergantung pada keberadaan reseptor-1 yang diaktifkan protease protein inang yang ada pada permukaan sel endotel, keping darah, dan monosit. Setelah terikat, bakteri ini memasuki sel inang melalui endositosis dan berakhir di dalam vesikel endositik. Saat vesikel menjadi asam, Burkholderia pseudomallei menggunakan sistem sekresi tipe 3 (T3SS) untuk menyuntikkan protein efektor ke dalam sel inang, sehingga mengganggu vesikel dan membiarkan bakteri keluar ke sitoplasma inang. Dalam sitoplasma inang, bakteri menghindari dari dibunuh oleh autofagi inang menggunakan pelbagai protein efektor T3SS. Bakteri ini bereplikasi di sitoplasma inang.[1][14]
Di dalam sel inang, Burkholderia pseudomallei bergerak dengan menginduksi polimerisasi aktin inang di belakangnya, sehingga mendorong bakteri ini ke depan.[1] Motilitas yang dimediasi aktin ini dicapai dengan autotransporter BimA yang berinteraksi dengan aktin di ujung ekor bakteri. Didorong oleh aktin, bakteri ini mendorong membran inang, sehingga menciptakan tonjolan yang meluas ke sel tetangga. Tonjolan ini menyebabkan sel-sel tetangga menyatu yang mengarah kepada pembentukan sel raksasa berinti banyak (MNGC). Ketika MNGC lisis, sel-sel tetangga membentuk plak (daerah bening pusat dengan cincin sel yang menyatu) yang menyediakan perlindungan bagi bakteri untuk replikasi lebih lanjut atau infeksi laten. Proses yang sama pada neuron yang terjangkit ini dapat memungkinkan bakteri melakukan perjalanan melalui akar saraf di sumsum tulang belakang dan otak yang menyebabkan peradangan otak dan sumsum tulang belakang. Selain menyebar dari sel ke sel, bakteri juga dapat menyebar melalui aliran darah sehingga menyebabkan sepsis. Bakteri ini dapat bertahan hidup dalam sel penyaji antigen dan sel dendritik. Dengan demikian, sel-sel ini bertindak sebagai kendaraan yang mengangkut bakteri ke dalam sistem limfatik, sehingga menyebabkan penyebaran bakteri secara luas dalam tubuh manusia.[1][14]
Manakala Burkholderia pseudomallei dapat bertahan hidup dalam sel fagosit, sel-sel fagosit ini dapat membunuh Burkholderia pseudomallei melalui beberapa mekanisme. Makrofag yang diaktifkan oleh interferon gamma menaikkan daya bunuh terhadap Burkholderiapseudomallei melalui produksi sintase oksida nitrat yang dapat diinduksi. Pengasaman endosom dan degradasi bakteri juga mungkin, tetapi kapsul bakteri dan LPS membuat Burkholderia pseudomallei resisten terhadap degradasi lisosom. Setelah Burkholderia pseudomallei lolos ke sitosol inang, bakteri ini dapat dikenali oleh reseptor pengenal pola seperti reseptor mirip NOD, sehingga memicu pembentukan inflamasom dan aktivasi kaspase 1 yang menginduksi kematian sel inang oleh piroptosis dan aktivasi lebih lanjut dari sel inang. sistem kekebalan tubuh. Beberapa pertahanan inang sistemik juga berkontribusi kepada respons imun. Burkholderia pseudomallei memicu sistem komplemen dan kaskade penggumpalan darah, namun kapsul bakteri yang tebal mencegah aksi kompleks serangan membran komplemen.[1][14]
Unsur tambahan dari sistem imun diaktifkan oleh reseptor mirip tol inang seperti TLR2, TLR4, dan TLR5 yang mengenali bagian-bagian bakteri ini yang terlindung dari kerusakan seperti LPS dan flagela. Aktivasi ini menghasilkan produksi sitokin seperti interleukin 1 beta (IL-1β) dan interleukin-18 (IL-18). IL-18 meningkatkan produksi IFN melalui sel pembunuh alami, sedangkan IL-1β mengurangi produksi IFN. Molekul imun ini mendorong pendayagunaan sel imun lain seperti neutrofil, sel dendritik, sel B, dan sel T ke tempat infeksi. Sel T tampaknya sangat penting untuk mengendalikan Burkholderia pseudomallei; jumlah sel T meningkat pada orang yang bertahan hidup dan jumlah sel T yang rendah dikaitkan dengan risiko kematian yang tinggi akibat melioidosis. Meskipun demikian, infeksi HIV bukan merupakan faktor risiko melioidosis. Meskipun makrofag menunjukkan respons sitokin yang dideregulasi pada individu dengan infeksi HIV, internalisasi bakteri dan pembunuhan intraseluler masih efektif. Orang yang terinfeksi Burkholderia pseudomallei mengembangkan antibodi terhadap bakteri, dan orang yang tinggal di daerah endemik cenderung memiliki antibodi dalam darah mereka yang mengenali Burkholderia pseudomallei, tetapi efektivitas antibodi ini dalam mencegah melioidosis tidak jelas.[1][14]
Burkholderia pseudomallei tetap dapat laten dalam tubuh manusia dari 19 sampai 29 tahun sampai diaktifkan kembali selama imunosupresi atau respons stres. Tempat bakteri selama infeksi laten dan mekanisme bakteri menghindari pengenalan imun selama bertahun-tahun tidak jelas. Di antara mekanisme yang disarankan adalah berada di inti sel untuk mencegah dicerna, memasuki tahap pertumbuhan yang lebih lambat, resistensi antibiotik, dan adaptasi genetik dengan lingkungan inang. Granuloma (mengandung neutrofil, makrofag, limfosit, dan sel raksasa berinti banyak) yang terbentuk di tempat infeksi pada melioidosis telah dikaitkan dengan infeksi laten pada manusia.[1]
Diagnosis
suntingKultur bakteri adalah diagnosis definitif melioidosis. Burkholderia pseudomallei tidak pernah menjadi bagian dari flora manusia. Oleh karena itu, setiap pertumbuhan bakteri adalah diagnostik melioidosis. Kultur darah adalah sampel yang paling umum untuk diagnosis karena bakteri dapat dideteksi dalam darah pada 50% hingga 60% kasus melioidosis. Sampel lain seperti tenggorokan, usap dubur, nanah dari bisul, dan dahak juga dapat digunakan untuk kultur. Ketika bakteri ini tidak tumbuh dari orang yang diduga kuat menderita melioidosis, kultur berulang harus dilakukan karena kultur berikutnya dapat menjadi positif.[1] Burkholderia pseudomallei dapat ditumbuhkan pada agar darah domba, agar MacConkey, media Ashdown (mengandung gentamisin),[1] atau kaldu Ashdown (mengandung kolistin).[3] Cawan agar untuk melioidosis harus diinkubasi pada suhu 37 °C di udara dan diperiksa selama empat hari berturut-turut.[2] Pada cawan agar, Burkholderia pseudomallei membentuk koloni yang berkrim dan nonhemolitik setelah diinkubasi selama dua hari. Setelah diinkubasi selama empat hari, koloni bakteri tampak kering dan berkerut.[1] Koloni Burkholderia pseudomallei yang ditumbuhkan pada media Francis (modifikasi media Ashdown dengan konsentrasi gentamisin ditingkatkan menjadi 8 mg/l) berwarna kuning. Untuk laboratorium yang berlokasi di luar daerah endemik, agar selektif Burkholderia cepacia atau agar selektif Pseudomonas dapat digunakan jika media Ashdown tidak tersedia.[2] Penting untuk tidak salah penafsiran bahwa pertumbuhan bakteri sebagai Pseudomonas atau Bacillus spp. Alat pemeriksaan biokimia lainnya juga dapat digunakan untuk mendeteksi Burkholderia pseudomallei, termasuk alay biokimia API 20NE atau 20E yang dipadukan dengan pewarnaan Gram, uji oksidase, ciri-ciri pertumbuhan yang khas, dan resistensi terhadap antibiotik tertentu dari bakteri tersebut.[3] Metode molekuler seperti kuar 16S rDNA dan reaksi berantai polimerase juga dapat digunakan untuk mendeteksi Burkholderia pseudomallei dalam kultur, tetapi hanya tersedia di laboratorium penelitian dan referensi.[1]
Tes darah umum pada penderita melioidosis menunjukkan jumlah sel darah putih yang rendah (menunjukkan infeksi), peningkatan enzim hati, peningkatan kadar bilirubin (menunjukkan disfungsi hati), dan peningkatan kadar urea dan kreatinin (menunjukkan disfungsi ginjal). Glukosa darah rendah dan asidosis memperkirakan prognosis yang lebih buruk pada mereka dengan melioidosis. Namun, uji lain seperti protein C-reaktif dan kadar prokalsitonin tidak dapat diandalkan dalam memperkirakan keparahan infeksi melioidosis.[18]
Dengan mikroskop, Burkholderia pseudomallei terlihat sebagai Gram-negatif dan berbentuk batang dengan pewarnaan bipolar mirip dengan peniti. Bakteri ini kadang-kadang dapat dilihat secara langsung dalam sampel klinis dari orang yang terinfeksi, tetapi identifikasi dengan mikroskop cahaya tidak spesifik atau sensitif. Mikroskop imunofluoresensi sangat spesifik untuk mendeteksi bakteri langsung dari spesimen klinis, tetapi sensitivitasnya kurang dari 50%. Sebuah immunoasai aliran lateral telah dikembangkan tetapi tidak dievaluasi secara ekstensif.[1][3] Semakin banyak laboratorium yang menggunakan spektrometri massa desorpsi/ionisasi laser berbantuan Matrix untuk mengidentifikasi bakteri secara akurat.[14]
Uji serologi seperti hemaglutinasi tidak langsung telah digunakan untuk mendeteksi keberadaan antibodi terhadap B. pseudomallei. Namun, kelompok orang yang berbeda memiliki tingkat antibodi yang sangat berbeda, jadi interpretasi tes ini bergantung pada lokasi. Di Australia, kurang dari 5% orang memiliki antibodi B. pseudomallei, sehingga keberadaan antibodi dalam jumlah yang relatif rendah tidak biasa dan dapat menunjukkan melioidosis. Di Thailand, banyak orang memiliki antibodi terhadap B. pseudomallei, sehingga hanya jumlah antibodi yang relatif tinggi dalam darah yang menunjukkan melioidosis.[1][3] Thailand juga menggunakan uji antibodi imunofluoresen langsung (IFAT) dan aglutinasi lateks. Dalam IFAT, antigen B. pseudomallei dan B. thailandensis dapat digunakan untuk mengukur jumlah antibodi yang dihasilkan terhadap bakteri. Oleh karena itu, hasil harus ditafsirkan dengan hati-hati karena reaksi positif palsu dapat ditemukan jika seseorang sebelumnya terpapar B. thailandensis nonpatogenik.[2] Aglutinasi lateks berguna dalam skrining untuk dugaan koloni B. pseudomallei colonies.[1] Alat ELISA komersial untuk melioidosis tidak lagi tersedia di pasaran karena sensitivitas yang rendah terhadap deteksi antibodi manusia.[14]
Berbagai modalitas pencitraan juga dapat membantu diagnosis melioidosis. Pada melioidosis akut dengan penyebaran bakteri melalui aliran darah, rontgen dada menunjukkan lesi nodular multifokal. Ini juga dapat menunjukkan penggabungan nodul atau kavitasi. Bagi mereka dengan melioidosis akut tanpa penyebaran ke aliran darah, rontgen dada menunjukkan konsolidasi lobus atas atau kavitasi. Pada melioidosis kronis, perkembangan lambat dari konsolidasi lobus atas paru-paru menyerupai tuberkulosis. Untuk abses yang terletak di bagian tubuh lain selain paru-paru, terutama di hati dan limpa, CT scan memiliki sensitivitas yang lebih tinggi jika dibandingkan dengan USG. Pada abses hati dan limpa, pemindaian ultrasound menunjukkan lesi "seperti target", sedangkan CT scan menunjukkan "tanda sarang lebah" pada abses hati. Untuk melioidosis yang melibatkan otak, MRI memiliki sensitivitas yang lebih tinggi daripada CT scan dalam mendiagnosis lesi. MRI menunjukkan lesi yang meningkatkan cincin untuk melioidosis otak.[14]
Pencegahan
suntingMelioidosis ialah penyakit yang harus dilaporkan di Australia. Ini memungkinkan Australia untuk memantau penyakit ini dan mengendalikan wabah. Melioidosis baru menjadi keadaan yang dapat dilaporkan di Thailand sejak Juni 2016. Walau begitu, Australia juga memulai kampanye kesadaran untuk meningkatkan pemahaman masyarakat tentang penyakit ini.[14] Di Amerika Serikat, pekerja laboratorium dapat menangani spesimen klinis dalam keadaan BSL-2, sementara produksi massal makhluk hidup ini memerlukan tindakan pencegahan BSL-3.[21] Beberapa kasus jangkitan melioidosis di rumah sakit juga telah dilaporkan, sehingga penyedia layanan kesehatan dianjurkan untuk mempraktikkan kebersihan tangan dan kewaspadaan universal.[1]
Klorinasi air berskala besar telah berhasil mengurangi Burkholderia pseudomallei di perairan Australia. Di negara-negara berpenghasilan rendah, air harus direbus sebelum diminum. Di negara-negara berpenghasilan tinggi, air dapat diolah dengan sinar ultraungu bagi mereka yang berisiko terjangkit melioidosis. Mereka yang berisiko tinggi berkontak dengan bakteri ini harus memakai alat pelindung seperti sepatu bot dan sarung tangan selama bekerja. Mereka yang tinggal di daerah endemik harus menghindari kontak langsung dengan tanah dan paparan luar ruangan terhadap hujan lebat atau awan debu. Air kemasan atau air matang lebih disarankan untuk diminum.[1]
Profilaksis pascapajanan
suntingSetelah terpapar Burkholderia pseudomallei (terutama setelah kecelakaan laboratorium), dianjurkan melakukan pengobatan dengan kotrimoksazol. Sebagai alternatif, koamoksiklav dan doksisiklin dapat digunakan untuk mereka yang tidak toleran terhadap kotrimoksazol. Karena kotrimoksazol dapat menyebabkan efek samping yang parah, hanya individu berisiko tinggi yang cenderung menerima perawatan tersebut. Sebagai gantinya, individu berisiko rendah akan sering menerima pemantauan.[1]
Vaksinasi
suntingBeberapa kandidat vaksin telah diuji pada model hewan. Walau demikian, tiada calon vaksin yang dicoba pada manusia. Hambatan utama vaksin adalah kemanjuran yang terbatas pada model hewan, menetapkan metode pemberian vaksin terbaik kepada manusia, serta masalah logistik dan keuangan dalam menetapkan uji coba pada manusia di daerah endemik.[14]
Perawatan
suntingPengobatan melioidosis dibagi menjadi dua tahap yaitu tahap intensif intravena dan tahap pemberantasan untuk mencegah perburukan. Pilihan antibiotik tergantung kepada kerentanan bakteri ini terhadap berbagai antibiotik. Burkholderia pseudomallei umumnya rentan terhadap seftazidim, meropenem, imipenem, dan koamoksiklav. Obat-obatan ini dirancang untuk membunuh bakteri ini. Bakteri ini juga rentan terhadap doksisiklin, kloramfenikol, dan kotrimoksazol. Obat-obatan ini dirancang untuk menghambat pertumbuhan bakteri ini. Bakteri ini but resisten terhadap penisilin, ampisilin, sefalosporin generasi pertama dan kedua, gentamisin, streptomisin, tobramisin, makrolida, dan polimiksin. Meskipun begitu, isolat Burkholderia pseudomallei dari Sarawak, Malaysia rentan terhadap gentamisin.[1]
Tahap intensif
suntingSeftazidim intravena adalah obat pilihan saat ini untuk pengobatan melioidosis akut dan harus diberikan sedikitnya 10 hari.[1] Meropenem, imipenem, dan perpaduan sefoperazon-sulbaktam (Sulperazone) juga efektif.[1][22] Amoksisilin-klavulanat (koamoksiklav) intravena dapat digunakan jika tidak ada empat obat di atas yang tersedia; koamoksiklav mencegah kematian akibat melioidosis, seperti halnya seftazidim.[12] Antibiotik intravena diberikan minimal 10 hari. Median waktu pembersihan demam pada melioidosis adalah 9 hari.[1]
Meropenem adalah terapi antibiotik pilihan untuk melioidosis neurologis dan penderita syok septik yang dirawat di unit perawatan intensif. Kotrimoksazol dianjurkan untuk melioidosis neurologis, osteomielitis, artritis septik, infeksi kulit dan gastrointestinal, dan bisul yang dalam. Untuk jangkitan yang mendalam seperti bisul organ dalam, osteomielitis, artritis septik, dan melioidosis neurologis, durasi antibiotik yang diberikan harus lebih lama (hingga 4 hingga 8 minggu). Waktu yang dibutuhkan demam untuk dituntaskan bisa lebih dari 10 hari pada penderita jangkitan yang mendalam. Resistensi terhadap seftazidim, karbapenem, dan koamoksiklav jarang terjadi pada tahap intensif, tetapi lebih menonjol selama terapi pemberantasan. Tiada perbedaan yang terlihat antara penggunaan sefoperazon/sulbaktam atau seftazidim untuk mengobati melioidosis karena keduanya menunjukkan tingkat kematian dan perkembangan penyakit yang serupa setelah pengobatan.[2] Bagi penderita gangguan ginjal, dosis seftazidim, meropenem, dan kotrimoksazol harus diturunkan.[3] Setelah kondisi klinis membaik, meropenem dapat dialihkan kembali ke seftazidim.[1] Kepastian terapi perpaduan seftazidim atau meropenem mengurangi tingkat keparahan pada tahap awal terapi masih belum jelas.[23]
Tahap pemberantasan
suntingSetelah pengobatan penyakit akut, pengobatan pemberantasan (atau pemeliharaan) dengan kotrimoksazol adalah obat pilihan dan harus digunakan sedikitnya selama 3 bulan. Bagi penderita melioidosis neurologis dan osteomielitis, obat ini harus diberikan selama lebih dari 6 bulan. Koamoksiklav dan doksisiklin adalah obat pilihan kedua. Kotrimoksazol tidak boleh digunakan kepada pasien penderita kekurangan glukosa-6-fosfat dehidrogenase karena dapat menyebabkan anemia hemolitik. Efek samping lain seperti ruam, hiperkalemia, disfungsi ginjal, dan gejala gastrointestinal, harus segera dikurangi dengan dosis kotrimoksazol. Kloramfenikol tidak lagi dianjurkan secara rutin untuk tujuan ini. Koamoksiklav adalah alternatif untuk pasien yang tidak dapat menggunakan kotrimoksazol dan doksisiklin (misalnya wanita hamil dan anak-anak di bawah 12 tahun), tetapi tidak seefektif kotrimoksazol dan doksisiklin serta memiliki tingkat keparahan yang lebih tinggi. Pengobatan agen tunggal dengan fluorokuinolon (misalnya siprofloksasin) atau doksisiklin untuk tahap pemeliharaan oral tidak efektif.[1]
Di Australia, kotrimoksazol digunakan oleh anak-anak dan ibu hamil setelah 12 minggu pertama kehamilan. Sementara itu di Thailand, koamoksiklav adalah obat pilihan untuk anak-anak dan ibu hamil. Namun, penggunaan koamoksiklav justru memicu resistensi dari Burkholderia pseudomallei. Kasus juga dilaporkan ketika melioidosis berhasil diobati dengan kotrimoksazol selama 3 bulan tanpa melalui terapi intensif asalkan hanya manifestasi kulit yang terlihat tanpa keterlibatan organ dalam atau sepsis.[1] Resistensi terhadap kotrimoksazol jarang terjadi di Australia.[2]
Pembedahan
suntingDrainase bedah diindikasikan untuk bisul tunggal yang besar di hati, otot, dan prostat. Namun, drainase bedah mungkin tidak dapat dilakukan atau diperlukan untuk beberapa bisul di hati, limpa, dan ginjal. Untuk septic arthritis, pengurasan artrotomi dan drainase diperlukan. Penyiangan bedah mungkin diperlukan. Bagi penderita aneurisma mikotik, operasi mendesak diperlukan untuk cangkok vaskular prostetik. Terapi seumur hidup dengan kotrimoksazol mungkin diperlukan bagi mereka yang menjalani cangkok vaskular prostetik. Bisul lainnya cenderung jarang memerlukan drainase karena sebagian besar bisul sembuh dengan pengobatan antibiotik.[1] Di Australia, bisul prostat mungkin memerlukan pencitraan dan drainase rutin.[18]
Perawatan lain
suntingTerapi imunomodulasi seperti faktor stimulasi koloni granulosit,[14] Interleukin 7, dan anti-PDI (kematian sel terprogram) dapat digunakan dalam pengobatan melioidosis terutama bagi mereka yang mengalami syok septik. Ini disebabkan obat ini dapat membantu meningkatkan fungsi kekebalan tubuh manusia terhadap Burkholderia pseudomallei.[1]
Prognosis
suntingDengan sumber daya yang baik, ketika penyakit dapat dideteksi dan diobati secara dini, risiko kematian berada di tingkat 10%. Dengan sumber daya yang buruk, tingkat risiko kematian meningkat hingga 40%.[1]
Bagi penderita yang tidak dirawat dengan baik, gejala muncul kembali setelah periode remisi penyakit ("keparahan") dapat terjadi. Kemudian, perawatan di rumah sakit diperlukan untuk antibiotik intravena. Bagi penderita yang telah berhasil menyelesaikan perawatan, keparahan juga dapat terjadi karena keparahan atau jangkitan melioidosis baru. Dengan terapi yang lebih baik, tingkat keparahan telah berkurang dari 10% menjadi 5%. Jangkitan baru kini lebih umum daripada keparahan. Faktor risiko keparahan termasuk kekambuhan penyakit (pesakit dengan kultur darah positif atau penyakit multifokal memiliki risiko kambuh yang lebih tinggi), pilihan antibiotik untuk terapi pemberantasan (monoterapi doksisiklin dan terapi fluorokuinolon tidak efektif), buruknya kepatuhan terhadap terapi pemberantasan dan durasi terapi pemberantasan kurang dari 8 minggu.[1]
Kondisi medis yang mendasar seperti diabetes mellitus, penyakit ginjal kronis, dan kanker dapat memperburuk kelangsungan hidup jangka panjang dan kecacatan penderita yang pulih dari jangkitan. Komplikasi melioidosis yang paling parah adalah ensefalomielitis. Ensefalomielitis dapat menyebabkan kuadriparesis (kelemahan otot di semua tungkai), paraparesis lembek parsial (kelemahan otot di kedua kaki), atau pelemahan kaki. Bagi penderita yang sebelumnya pernah mengalami infeksi tulang dan sendi terkait melioidosis, komplikasi seperti infeksi sinus, kelainan bentuk tulang dan sendi dengan rentang gerak terbatas dapat terjadi.[1]
Epidemiologi
suntingMelioidosis adalah penyakit yang belum diteliti dan masih endemik di negara berkembang. Pada tahun 2015, Masyarakat Melioidosis Internasional dibentuk untuk meningkatkan kesadaran akan penyakit ini.[1] Pada tahun 2016, model statistik yang dikembangkan menunjukkan angka 165.000 kasus tiap tahun dengan 138.000 kasus di antaranya terjadi di Asia Timur dan Selatan serta Pasifik.[24] Sekitar setengah dari jumlah kasus (54% atau 89.000 kasus) akan meninggal. Rendahnya angka yang dilaporkan adalah masalah umum karena hanya 1.300 kasus yang dilaporkan di seluruh dunia sejak tahun 2010, kurang dari 1% dari insidensi yang diproyeksikan berdasarkan pemodelan. Kurangnya kemampuan diagnostik laboratorium dan kurangnya kesadaran penyakit di antara penyedia layanan kesehatan juga menyebabkan rendahnya diagnosis. Bahkan jika kultur bakteri menjadi positif untuk Burkholderia pesudomallei, kultur bakteri dapat dibuang sebagai kontaminan terutama di laboratorium daerah bukan endemik. Pada 2018, melioidosis tidak termasuk dalam daftar penyakit tropis terabaikan Organisasi Kesehatan Dunia.[1]
Melioidosis ialah penyakit endemik di beberapa bagian Asia Tenggara (termasuk Thailand,[25] Laos,[26] Singapura,[27] Brunei Darussalam,[28] Malaysia,[29] Myanmar,[30] dan Vietnam[31]), selatan Cina,[32] Taiwan,[33] dan utara Australia.[34] Curah hujan yang tinggi dapat memperluas penyebaran melioidosis hingga tengah Australia.[34] India,[35] dan kasus sporadis di Amerika Selatan.[36] Beban sebenarnya dari melioidosis di Afrika dan Timur Tengah tetap tidak diketahui karena rendahnya jumlah data. Ada 24 negara Afrika dan tiga negara Timur Tengah yang diperkirakan menjadi daerah endemik melioidosis, tetapi tidak satu kasus pun dilaporkan dari mereka.[37] Sebanyak 51 kasus melioidosis dilaporkan di Bangladesh sejak tahun 1961 hingga tahun 2017. Meskipun demikian, kurangnya kesadaran dan sumber daya menimbulkan rendahnya diagnosis penyakit di Bangladesh.[38] Di Amerika Serikat, empat negara bagian masing-masing melaporkan satu kasus pada tahun 2021, dengan dua kasus di antaranya berakibat fatal, di antaranya pesakit yang tidak memiliki riwayat perjalanan ke luar negeri terkini. Pusat Pengendalian dan Pencegahan Penyakit Amerika Serikat menemukan Burkholderia pseudomallei dalam semprotan ruangan beraroma di sebuab rumah pesakit.[39] Sebelumnya di Amerika Serikat, dua kasus lama (1950 dan 1971) dan tiga kasus baru (2010, 2011, 2013) dilaporkan di antara orang-orang yang tidak bepergian ke luar negeri. Terlepas dari penyelidikan yang luas, sumber melioidosis tidak pernah dikonfirmasi. Sebuah penjelasan yang mungkin adalah impor produk tanaman obat atau reptil eksotik dapat mengakibatkan masuknya melioidosis ke Amerika Serikat.[3] Di Eropa, lebih dari setengah kasus melioidosis adalah kasus impor asal Thailand.[40]
Melioidosis ditemukan pada semua kelompok umur. Untuk Australia dan Thailand, usia rata-rata jangkitan adalah 50 tahun dengan 5% hingga 10% pesakit berusia di bawah 15 tahun.[1] Satu-satunya faktor risiko terpenting untuk menderita melioidosis adalah diabetes mellitus, diikuti oleh penggunaan alkohol yang berbahaya, penyakit ginjal kronis, dan penyakit paru-paru kronis.[41] Lebih dari 50% penderita melioidosis menderita diabetes, dengan penderita diabetes berisiko mengalami peningkatan keterjangkitan melioidosis hingga 12 kali lipat. Diabetes menurunkan kemampuan makrofag dalam melawan bakteri dan mengurangi produksi sel T pembantu. Pelepasan faktor nekrosis tumor alfa berlebihan dan interleukin 12 oleh sel inti tunggal meningkatkan risiko syok septik. Obat diabetes glibenklamida juga dapat menumpulkan respons radang monosit.[1] Faktor risiko lain termasuk talasemia, paparan pekerjaan (misalnya petani padi),[14] paparan rekreasional ke tanah, air, menjadi laki-laki, usia lebih dari 45 tahun, dan penggunaan steroid/imunosupresi berkepanjangan, tetapi 8% dari anak-anak dan 20% dari orang dewasa penderita melioidosis tidak memiliki faktor risiko.[1] Jangkitan HIV tidak menjadi predisposisi melioidosis.[14] Kasus bayi telah dilaporkan mungkin karena penularan dari ibu ke anak, jangkitan yang didapat dari masyarakat, atau jangkitan terkait layanan kesehatan.[1] Mereka yang sehat juga dapat terjangkir Burkholderia pseudomallei. Misalnya, 25% anak-anak yang tinggal di daerah endemik mulai memproduksi antibodi terhadap Burkholderia pseudomallei antara usia 6 bulan dan 4 tahun, yang menunjukkan bahwa mereka terpapar selama waktu tersebut. Ini berarti banyak orang tanpa gejala akan dinyatakan terjangkit dalam uji serologi di daerah endemik.[2] Di Thailand, tingkat keterjangkitan darah melebihi 50%, sementara di Australia, tingkat keterjangkitan darah hanya 5%.[3] Penyakit ini benar-benar berkaitan dengan peningkatan curah hujan dengan jumlah kasus meningkat selaras dengan peningkatan curah hujan. Curah hujan yang tinggi meningkatkan konsentrasi bakteri ini di lapisan tanah atas sehingga meningkatkan risiko penularan bakteri ini melalui udara.[14]
Sejarah
suntingPatolog Alfred Whitmore dan asistennya Krishnaswami pertama kali melaporkan melioidosis di antara pengemis dan pecandu morfin dalam autopsi di Rangoon (kini di Myanmar) dalam laporan yang diterbitkan pada tahun 1912.[5] Arthur Conan Doyle mungkin telah membaca laporan tahun 1912 sebelum menulis cerita pendek yang melibatkan penyakit tropis fiktif bernama "demam Tapanuli" dalam cerita petualangan Sherlock Holmes.[42] Dalam cerita "The Adventure of the Dying Detective" (1913), Sherlock menerima sebuah kotak yang dirancang untuk menyuntik korbannya dengan "Demam Tapanuli" saat dibuka. "Demam Tapanuli" dianggap oleh banyak orang sebagai melioidosis.[18] Istilah "melioidosis" pertama kali dicetuskan pada tahun 1921.[1] Penyakit ini dibedakan dari glander, penyakit manusia dan hewan yang serupa dalam wujudnya, tetapi disebabkan oleh mikroorganisme yang berbeda. Burkholderia pseudomallei yang juga dikenal dengan Whitmore bacillus diidentifikasi pada tahun 1917 di Kuala Lumpur.[[43] Kasus melioidosis manusia pertama dilaporkan di Sri Lanka pada tahun 1927. Pada tahun 1932, 83 kasus dilaporkan di Asia Selatan dan Tenggara dengan tingkat kematian 98%. Pada tahun 1936, kasus melioidosis hewan (domba) pertama dilaporkan di Madagaskar, Afrika Selatan. Pada tahun 1937, tanah dan air diidentifikasi sebagai habitat Burkholderia pseudomallei.[1] Selama Perang Vietnam sejak tahun 1967 hingga 1973, 343 tentara Amerika Serikat dilaporkan terjangkit melioidosis dengan sekitar 50 kasus tetrular melalui hirupan. Wabah melioidosis di Kebun Binatang Paris pada dasawarsa 1970-an (dikenal sebagai L'affaire du jardin des plantes) diperkirakan berasal dari panda atau kuda impor dari Iran.[18][44] Bukti pertama Burkholderia pseudomallei (dalam tanah) di Brasil dilaporkan pada tahun 1983.[1]
Sebelum tahun 1989, pengobatan standar untuk melioidosis akut ialah perpaduan tiga obat yang terdiri dari kloramfenikol, kotrimoksazol, dan doksisiklin; perpaduan obat ini dikaitkan dengan tingkat kematian 80% dan tidak lagi digunakan kecuali tiada alternatif lain yang tersedia.[45] Ketiga obat ini bersifat bakteriostatik (hanya menghentikan pertumbuhan bakteri alih-alih langsung membunuh bakteri) dan kerja kotrimoksazol berlawanan dengan kloramfenikol dan doksisiklin.[46] Burkholderia pseudomallei yang sudah diaerosolkan pertama kali diisolasi pada tahun 1989. Pada tahun yang sama, seftazidim telah terbukti mengurangi risiko kematian melioidosis dari 74% menjadi 37%.[1] Burkholderia pseudomallei sebelumnya diklasifikasikan sebagai bagian dari genus Pseudomonas sampai tahun 1992.[6] Pada tahun 1992, patogen ini secara formal bernama Burkholderia pseudomallei.[1] Pada tahun 2002, Burkholderia pseudomallei diklasifikasikan sebagai agen kategori B. Vaksin yang dilemahkan hidup dikembangkan pada tikus pada tahun yang sama. Pada tahun 2003, pengetikan urutan multilokus untuk Burkholderia pseudomallei dikembangkan. Pada tahun 2012, Burkholderia pseudomallei diklasifikasikan sebagai agen pilihan tingkat 1 oleh Pusat Pengendalian dan Pencegahan Penyakit Amerika Serikat. Pada tahun 2014, kotrimoksazol ditetapkan sebagai terapi pemberantasan oral. Pada tahun 2015, DNA Burkholderia pseudomallei terdeteksi di udara yang disaring menggunakan PCR kuantitatif. Pada tahun 2016, model statistik dikembangkan untuk memperkirakan terjadinya melioidosis global tiap tahun. Pada tahun 2017, Australia diperkirakan sebagai asal-usul melioidosis terawal berdasarkan pengurutan keseluruhan genom.[1]
Senjata biologi
suntingMinat pada melioidosis telah dinyatakan karena berpotensi dikembangkan menjadi senjata biologi. Bakteri serupa lainnya yaitu Burkholderia mallei digunakan oleh Jerman dalam Perang Dunia I untuk menjangkiti ternak yang dikirim ke negara-negara Sekutu.[22] Jangkitan terhadap tawanan perang dan hewan yang disengaja menggunakan Burkholderia mallei dilakukan di Distrik Pingfang, Harbin, Heilongjiang, Tiongkok, oleh Jepang semasa Perang Dunia II.[18] Diduga Uni Soviet menggunakan Burkholderia mallei semasa Perang Uni Soviet–Afganistan antara tahun 1982 dan 1984.[22] Seperti halnya Burkholderia mallei, Burkholderia pseudomallei dipelajari oleh Amerika Serikat dan Uni Soviet sebagai agen perang biologis yang potensial,[47] tetapi tidak pernah dijadikan senjata.[22] Negara-negara lain seperti Iran, Irak, Korea Utara, dan Suriah mungkin telah menyelidiki sifat-sifat Burkholderia pseudomallei untuk senjata biologis. Bakteri ini tersedia di lingkungan dan hemat biaya untuk diproduksi. Bakteri ini juga dapat diaerosolkan dan ditularkan melalui hirupan. Namun, Burkholderia pseudomallei tidak pernah digunakan dalam peperangan biologi.[2]
Referensi
sunting- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak al am an ao ap aq ar as at au av aw ax ay az ba bb bc bd be bf bg bh bi bj bk bl bm bn bo bp bq br bs bt bu bv bw bx by bz ca cb Wiersinga WJ, Virk HS, Torres AG, Currie BJ, Peacock SJ, Dance DA, Limmathurotsakul D (February 2018). "Melioidosis". Nature Reviews. Disease Primers. 4 (17107): 17107. doi:10.1038/nrdp.2017.107. PMC 6456913 . PMID 29388572.
- ^ a b c d e f g h i j k l m n o p q r s t u Foong YC, Tan M, Bradbury RS (30 October 2014). "Melioidosis: a review". Rural and Remote Health. 14 (4): 2763. PMID 25359677.
- ^ a b c d e f g h i j k l m n o p Currie BJ (February 2015). "Melioidosis: evolving concepts in epidemiology, pathogenesis, and treatment". Seminars in Respiratory and Critical Care Medicine. 36 (1): 111–25. doi:10.1055/s-0034-1398389 . PMID 25643275.
- ^ a b c Brightman, Christopher; Locum (2020). "Melioidosis: the Vietnamese time bomb". Trends in Urology & Men's Health (dalam bahasa Inggris). 11 (3): 30–32. doi:10.1002/tre.753 . ISSN 2044-3749.
- ^ a b c Whitmore A, Krishnaswami CS (1912). "An account of the discovery of a hitherto undescribed infectious disease among the population of Rangoon". Indian Medical Gazette. 47: 262–267.
- ^ a b Stanton AT, Fletcher W (1921). "Melioidosis, a new disease of the tropics". Far Eastern Association of Tropical Medicine: Transactions of the Fourth Congress. Batavia, Dutch East Indies: Javasche Boekhandel en Drukkerij.
- ^ Chai LY, Fisher D (August 2018). "Earth, wind, rain, and melioidosis". The Lancet. Planetary Health. 2 (8): e329–e330. doi:10.1016/S2542-5196(18)30165-7 . PMID 30082045.
- ^ Barker A (19 June 2005). "Rise in melioidosis rates in NT". Australian Broadcasting Corporation. Diakses tanggal 2007-06-24.
- ^ Orellana C (November 2004). "Melioidosis strikes Singapore". The Lancet. Infectious Diseases. 4 (11): 655. doi:10.1016/S1473-3099(04)01190-9. PMID 15534940.
- ^ Krishnaswami CS. "Morphia injectors' septicaemia". Indian Medical Gazette. 52 (1917): 296–299.
- ^ Currie BJ, Ward L, Cheng AC (2010). "The epidemiology and clinical spectrum of melioidosis: 540 cases from the 20 year Darwin prospective study". PLOS Negl Trop Dis. 4 (11): e900. doi:10.1371/journal.pntd.0000900. PMC 2994918 . PMID 21152057.
- ^ a b c Bennett JE, Raphael D, Martin JB, Currie BJ (2015). "223". Mandell, Douglas, and Bennett's Principles and Practice of Infectious Diseases (edisi ke-Eighth). Elsevier. hlm. 2541–2549. ISBN 978-1-4557-4801-3.
- ^ Fertitta L, Monsel G, Torresi J, Caumes E (February 2019). "Cutaneous melioidosis: a review of the literature". International Journal of Dermatology. 58 (2): 221–227. doi:10.1111/ijd.14167. hdl:11343/284394 . PMID 30132827.
- ^ a b c d e f g h i j k l m n o p q r Gassiep I, Armstrong M, Norton R (March 2020). "Human Melioidosis". Clinical Microbiology Reviews. 33 (2). doi:10.1128/CMR.00006-19. PMC 7067580 . PMID 32161067.
- ^ a b Ngauy V, Lemeshev Y, Sadkowski L, Crawford G (February 2005). "Cutaneous melioidosis in a man who was taken as a prisoner of war by the Japanese during World War II". Journal of Clinical Microbiology. 43 (2): 970–2. doi:10.1128/JCM.43.2.970-972.2005. PMC 548040 . PMID 15695721.
- ^ Gee JE, Gulvik CA, Elrod MG, Batra D, Rowe LA, Sheth M, Hoffmaster AR (July 2017). "Phylogeography of Burkholderia pseudomallei Isolates, Western Hemisphere". Emerging Infectious Diseases. 23 (7): 1133–1138. doi:10.3201/eid2307.161978. PMC 5512505 . PMID 28628442.
- ^ Chodimella U, Hoppes WL, Whalen S, Ognibene AJ, Rutecki GW (May 1997). "Septicemia and suppuration in a Vietnam veteran". Hospital Practice. 32 (5): 219–21. doi:10.1080/21548331.1997.11443493. PMID 9153149.
- ^ a b c d e f g Cheng AC, Currie BJ (April 2005). "Melioidosis: epidemiology, pathophysiology, and management". Clinical Microbiology Reviews. 18 (2): 383–416. doi:10.1128/CMR.18.2.383-416.2005. PMC 1082802 . PMID 15831829.
- ^ Baker A, Pearson T, Price EP, Dale J, Keim P, Hornstra H, et al. (March 2011). "Molecular phylogeny of Burkholderia pseudomallei from a remote region of Papua New Guinea". PLOS ONE. 6 (3): e18343. Bibcode:2011PLoSO...618343B. doi:10.1371/journal.pone.0018343 . PMC 3069084 . PMID 21483841.
- ^ "2021 Multistate outbreak of melioidosis | Melioidosis | CDC". www.cdc.gov (dalam bahasa Inggris). 2021-11-04. Diakses tanggal 2021-11-08.
- ^ Centers for Disease Control and Prevention (2009). Biosafety in Microbiological and Biomedical Laboratories (edisi ke-5th). Atlanta, Georgia: National Institutes of Health.
- ^ a b c d Nguyen HV, Smith ME, Hayoun MA (29 August 2021). "Glanders and Melioidosis". StatPearls. StatPearls Publishing. PMID 28846298. NBK448110.
- ^ Samuel M, Ti TY, et al. (Cochrane Infectious Diseases Group) (2002-10-21). "Interventions for treating melioidosis". The Cochrane Database of Systematic Reviews (4): CD001263. doi:10.1002/14651858.CD001263. PMC 6532693 . PMID 12519552.
- ^ Limmathurotsakul D, Golding N, Dance DA, Messina JP, Pigott DM, Moyes CL, et al. (January 2016). "Burkholderia pseudomallei and burden of melioidosis". Nature Microbiology. 1 (1): 15008. doi:10.1038/nmicrobiol.2015.8. PMC 4746747 . PMID 26877885.
- ^ Hinjoy S, Hantrakun V, Kongyu S, Kaewrakmuk J, Wangrangsimakul T, Jitsuronk S, et al. (8 April 2018). "Melioidosis in Thailand: Present and Future". Tropical Medicine and Infectious Disease. 3 (2): 38. doi:10.3390/tropicalmed3020038 . PMC 5928800 . PMID 29725623.
- ^ Dance DA, Luangraj M, Rattanavong S, Sithivong N, Vongnalaysane O, Vongsouvath M, Newton PN (February 2018). "Melioidosis in the Lao People's Democratic Republic". Tropical Medicine and Infectious Disease. 3 (1): 21. doi:10.3390/tropicalmed3010021 . PMC 6136615 . PMID 30274419.
- ^ Sim SH, Ong CE, Gan YH, Wang D, Koh VW, Tan YK, et al. (March 2018). "Melioidosis in Singapore: Clinical, Veterinary, and Environmental Perspectives". Tropical Medicine and Infectious Disease. 3 (1): 31. doi:10.3390/tropicalmed3010031 . PMC 6136607 . PMID 30274428.
- ^ Pande K, Abd Kadir KA, Asli R, Chong VH (February 2018). "Melioidosis in Brunei Darussalam". Tropical Medicine and Infectious Disease. 3 (1): 20. doi:10.3390/tropicalmed3010020 . PMC 6136610 . PMID 30274418.
- ^ Nathan S, Chieng S, Kingsley PV, Mohan A, Podin Y, Ooi MH, et al. (February 2018). "Melioidosis in Malaysia: Incidence, Clinical Challenges, and Advances in Understanding Pathogenesis". Tropical Medicine and Infectious Disease. 3 (1): 25. doi:10.3390/tropicalmed3010025 . PMC 6136604 . PMID 30274422.
- ^ Win MM, Ashley EA, Zin KN, Aung MT, Swe MM, Ling CL, et al. (March 2018). "Melioidosis in Myanmar". Tropical Medicine and Infectious Disease. 3 (1): 28. doi:10.3390/tropicalmed3010028 . PMC 6136617 . PMID 30274425.
- ^ Trinh TT, Nguyen LD, Nguyen TV, Tran CX, Le AV, Nguyen HV, et al. (April 2018). "Melioidosis in Vietnam: Recently Improved Recognition but still an Uncertain Disease Burden after Almost a Century of Reporting". Tropical Medicine and Infectious Disease. 3 (2): 39. doi:10.3390/tropicalmed3020039 . PMC 6073866 . PMID 30274435.
- ^ Zheng X, Xia Q, Xia L, Li W (February 2019). "Endemic Melioidosis in Southern China: Past and Present". Tropical Medicine and Infectious Disease. 4 (1): 39. doi:10.3390/tropicalmed4010039 . PMC 6473618 . PMID 30823573.
- ^ Hsueh PT, Huang WT, Hsueh HK, Chen YL, Chen YS (February 2018). "Transmission Modes of Melioidosis in Taiwan". Tropical Medicine and Infectious Disease. 3 (1): 26. doi:10.3390/tropicalmed3010026 . PMC 6136622 . PMID 30274423.
- ^ a b Smith S, Hanson J, Currie BJ (March 2018). "Melioidosis: An Australian Perspective". Tropical Medicine and Infectious Disease. 3 (1): 27. doi:10.3390/tropicalmed3010027 . PMC 6136632 . PMID 30274424.
- ^ Mukhopadhyay C, Shaw T, Varghese GM, Dance DA (May 2018). "Melioidosis in South Asia (India, Nepal, Pakistan, Bhutan and Afghanistan)". Tropical Medicine and Infectious Disease. 3 (2): 51. doi:10.3390/tropicalmed3020051 . PMC 6073985 . PMID 30274447.
- ^ Rolim DB, Lima RX, Ribeiro AK, Colares RM, Lima LD, Rodríguez-Morales AJ, et al. (June 2018). "Melioidosis in South America". Tropical Medicine and Infectious Disease. 3 (2): 60. doi:10.3390/tropicalmed3020060 . PMC 6073846 . PMID 30274456.
- ^ Steinmetz I, Wagner GE, Kanyala E, Sawadogo M, Soumeya H, Teferi M, et al. (June 2018). "Melioidosis in Africa: Time to Uncover the True Disease Load". Tropical Medicine and Infectious Disease. 3 (2): 62. doi:10.3390/tropicalmed3020062 . PMC 6073667 . PMID 30274458.
- ^ Chowdhury FR, Jilani MS, Barai L, Rahman T, Saha MR, Amin MR, et al. (April 2018). "Melioidosis in Bangladesh: A Clinical and Epidemiological Analysis of Culture-Confirmed Cases". Tropical Medicine and Infectious Disease. 3 (2): 40. doi:10.3390/tropicalmed3020040 . PMC 6073520 . PMID 30274436.
- ^ Division of High-Consequence Pathogens and Pathology (October 22, 2021). "2021 Multistate outbreak of melioidosis". www.cdc.gov (dalam bahasa Inggris). Centers for Disease Control and Prevention, National Center for Emerging and Zoonotic Infectious Diseases. Diarsipkan dari versi asli tanggal 2021-10-23. Diakses tanggal 2021-10-24.
- ^ Le Tohic S, Montana M, Koch L, Curti C, Vanelle P (August 2019). "A review of melioidosis cases imported into Europe". European Journal of Clinical Microbiology & Infectious Diseases. 38 (8): 1395–1408. doi:10.1007/s10096-019-03548-5. PMID 30949898.
- ^ Suputtamongkol Y, Chaowagul W, Chetchotisakd P, Lertpatanasuwun N, Intaranongpai S, Ruchutrakool T, et al. (August 1999). "Risk factors for melioidosis and bacteremic melioidosis". Clinical Infectious Diseases. 29 (2): 408–13. doi:10.1086/520223 . PMID 10476750.
- ^ Vora SK (February 2002). "Sherlock Holmes and a biological weapon". Journal of the Royal Society of Medicine. 95 (2): 101–3. doi:10.1258/jrsm.95.2.101. PMC 1279324 . PMID 11823558.
- ^ Strong, Richard P (1944). Stitt's Diagnosis, Prevention and Treatment of Tropical Diseases (edisi ke-7th). Philadelphia: The Blakiston Company. hlm. 732.
- ^ Mollaret HH (1988). ""L'affaire du Jardin des plantes" ou comment le mélioïdose fit son apparition en France". Médecine et Maladies Infectieuses. 18 (Suppl 4): 643–654. doi:10.1016/S0399-077X(88)80175-6.
- ^ White NJ, Dance DA, Chaowagul W, Wattanagoon Y, Wuthiekanun V, Pitakwatchara N (September 1989). "Halving of mortality of severe melioidosis by ceftazidime". Lancet. 2 (8665): 697–701. doi:10.1016/S0140-6736(89)90768-X. PMID 2570956.
- ^ Dance DA, Wuthiekanun V, Chaowagul W, White NJ (September 1989). "Interactions in vitro between agents used to treat melioidosis". The Journal of Antimicrobial Chemotherapy. 24 (3): 311–6. doi:10.1093/jac/24.3.311. PMID 2681117.
- ^ Withers MR, ed. (2014). USAMRIID's Medical Management of Biological Casualties Handbook (PDF) (edisi ke-8th). Fort Detrick, Maryland: U.S. Army Medical Institute of Infectious Diseases. hlm. 53. Diarsipkan dari versi asli (PDF) tanggal 2021-05-14. Diakses tanggal 2021-12-07.
Pranala luar
sunting| Klasifikasi | |
|---|---|
| Sumber luar |
- Resource Center for melioidosis
- Templat:CDCDiseaseInfo
- Burkholderia pseudomallei genomes and related information at PATRIC, a Bioinformatics Resource Center funded by NIAID
- Monograph on Melioidosis (ISBN 978-0-444-53479-8); Elsevier Press, 2012, https://www.researchgate.net/publication/354857974_Monograph_Melioidosis-a-century-of-observation-and-research_ISBN_978-0-444-53479-8