Pirimidina
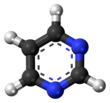
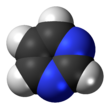
Pirimidina (bahasa Inggris: Pyrimidine) adalah suatu senyawa organik heterosiklik aromatik yang mirip dengan piridina.[2] Satu dari tiga diazina (senyawa heterosiklik enam karbon dengan dua nitrogen pada cincin), mempunyai nitrogen pada posisi 1 dan 3 dalam cincin.[3] Kedua diazina lain adalah pirazina (nitrogen pada posisi 1 dan 4) dan piridazina ( pada posisi 1 dan 2). Dalam asam nukleat, ketiga tipe basa nukleotida merupakan derivat pirimidin yaitu: sitosina (= cytosine) (C), timina (T), dan urasil (U).
| |||
| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC
Pyrimidine
| |||
| Nama lain
1,3-Diazine, m-Diazine
| |||
| Penanda | |||
Model 3D (JSmol)
|
|||
| 3DMet | {{{3DMet}}} | ||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| Nomor EC | |||
| KEGG | |||
| MeSH | pyrimidine | ||
PubChem CID
|
|||
| Nomor RTECS | {{{value}}} | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Sifat | |||
| C4H4N2 | |||
| Massa molar | 80.088 g mol−1 | ||
| Densitas | 1.016 g cm−3 | ||
| Titik lebur | 20 °C (68 °F; 293 K) | ||
| Titik didih | 123 °C (253 °F; 396 K) | ||
| Keasaman (pKa) | 1.10[1] (protonated pyrimidine) | ||
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |||
| Referensi | |||
Keberadaan dan sejarah
suntingSistem cincin pirimidina banyak dijumpai dalam alam[4] sebagai senyawa berfusi substitusi dan cincin serta derivatifnya, termasuk nukleotida, tiamina (vitamin B1) dan alloxan. Juga didapati dalam banyak senyawa sintetik seperti barbiturat dan obat HIV, zidovudine. Meskipun derivatif pirimidina seperti asam urat dan alloxan telah dikenal sejak awal abad ke-19, sintesis pirimidina dalam laboratorium baru dilakukan pada tahun 1879,[4] ketika Grimaux melaporkan pembuatan asam barbiturat dari urea Ivy dan asam malonat dengan katalis fosfor oxiklorida.[5] Studi sistematik pirimidina dimulai[6] pada tahun 1884 oleh Pinner,[7] yang melakukan sintesis derivatif melalui kondensasi etil asetoasetat dengan amidina. Pinner pertama kali mengusulkan nama “pyrimidin” pada tahun 1885.[8] Senyawa induk pertama kali dibuat oleh Gabriel & Colman pada tahun 1900,[9] [10] melalui konversi asam barbiturat menjadi 2,4,6-trikloropirimidina diikuti oleh reduksi menggunakan debu seng dalam air panas.
Nomenklatur
suntingNomenklatur pirimidina tergolong sederhana. Namun, sebagaimana heterosiklik lainnya, gugus hidroksil tautomerik menghasilkan komplikasi karena mereka adanya terutama dalam bentuk amida siklik. Misalnya, 2-hidroksipirimidina lebih tepat dinamai [struktur] 2-pirimidon. Tersedia daftar sebagian nama-nama trivial dari berbagai pirimidina.[11]
Sifat fisika
suntingSifat-sifat fisika dapat dilihat pada kotak info. Diskusi lebih mendalam, termasuk spektrum, dapat dilihat dalam Brown et al.[12]
Sifat kimia
suntingMenurut klasifikasi Albert[13] heterosiklik enam karbon dapat dikatakan "π-deficient" ("kekurangan π"). Substitusi oleh gugus elektronegatif atau atom nitrogen tambahan dalam cincin secara signifikan meningkatkan "kekurangan π" itu. Efek ini juga menurunkan kadar basa.[14]
Sebagaimana piridina, dalam pirimidina densitas elektron π menurun sampai taraf lebih besar. Karenanya, substitusi aromatik elektrofilik lebih sulit sementara substitusi aromatik nukleofilik terbantu. Contoh jenis reaksi terakhir adalah penghilangan gugus amino dalam 2-aminopirimidina oleh klor.[15] dan reaksi sebaliknya.[16]
Ketersediaan pasangan elektron tunggal (kadar basa) menurun dibandingkan piridina. Dibandingkan piridina, N-alkilasi dan N-oksidasi lebih sulita. Nilai pKa untuk pirimidina terprotonasi adalah 1,23 dibandingkan 5,30 untuk piridina. Protonasi dan tambahan elektrofilik lain akan terjadi pada hanya satu nitrogen karena deaktivasi lebih lanjut oleh nitrogen kedua.[3] Posisi 2-, 4-, dan 6- pada cincin pirimidina merupakan analog kekurangan elektron dari senyawa pyridina dan nitro- serta dinitrobenzena. Posisi 5 lebih rendah tingkat kekurangan elektronnya dan substituen di sana sangat stabil. Namun, substitusi eletrofilik relatif lancar pada posisi 5, termasuk nitrasi dan halogenasi.[17]
Reduksi dalam stabilisasi resonansi pirimidina dapat lebih menghasilkan reaksi adisi dan pemutusan cincin daripada substitusi. Salah satu manifestasinya dapat diamati pada "Dimroth rearrangement".
Pirimidina juga ditemukan pada meteorit, tetapi para ilmuwan masih tidak tahu asal usulnya. Pirimidina juga secara fotolitik mengalami dekomposisi menjadi urasil di bawah cahaya UV.[18]
Sintesis
suntingSebagaimana sering kali dijumpai pada sistem heterosiklik induk, sintesis pirimidina tidak begitu lazim dan biasanya dilakukan dengan menghilangan gugus fungsi dari derivatif. Sintesis primer dalam jumlah besar melibatkan formamida telah dilaporkan.[19]
Sebagai suatu kelas, pirimidina biasanya disintesis melalui “Principal Synthesis” melibatkan siklisasi senyawa beta-dikarbonil dengan senyawa N-C-N. Reaksi sebelumnya dengan amidina menghasilkan substitusi pirimidina pada posisi 2, biasanya dengan urea menghasilkan 2-pirimidion, dan dengan guanidina menghasilkan 2-aminopirimidina.[20]
Reaksi
suntingKarena menurunnya kadar basa dibandingkan piridina, substitusi elektrofilik pirimidina kurang lancar. Protonasi atau alkilasi biasanya berlangsung pada hanya satu atom nitrogen dalam cincin. Oksidasi-N mono terjadi melalui reaksi dengan perasida.[21]
Nukleotida
suntingTiga nucleobase yang ditemukan dalam asam nukleat, yaitu sitosina/cytosine (C), timina (T), dan urasil (U), merupakan derivatif pirimidina:
Dalam DNA dan RNA, basa-basa ini membentuk ikatan hidrogen dengan purina komplementer. Jadi, dalam DNA, senyawa purina adenina (A) dan guanina (G) masing-masing berpasangan dengan senyawa pirimidina timina (T) dan sitosina (C), membentuk pasangan-pasangan A:T dan G:C.
Dalam RNA, komplemen adenina (A) adalah urasil (U) bukannya timina (T), sehingga pasangan yang dibentuk adalah adenina:urasil (A:U) dan guanina:sitosina (G:C).
Lihat pula
suntingReferensi
sunting- ^ Brown, H.C., et al., in Baude, E.A. and Nachod, F.C., Determination of Organic Structures by Physical Methods, Academic Press, New York, 1955.
- ^ Gilchrist, Thomas Lonsdale; Gilchrist, T. L. (1997). Heterocyclic chemistry. New York: Longman. ISBN 0-582-27843-0.
- ^ a b Joule, John A.; Mills, Keith, ed. (2010). Heterocyclic Chemistry (edisi ke-5th). Oxford: Wiley. hlm. 250. ISBN 978-1-405-13300-5.
- ^ a b Lagoja, Irene M. (2007). "Pyrimidine as Constituent of Natural Biologically Active Compounds" (PDF). Chemistry and Biodiversity. 2 (1): 1–50. doi:10.1002/cbdv.200490173. PMID 17191918. Diarsipkan dari versi asli (PDF) tanggal 2017-02-15. Diakses tanggal 2014-12-13.
- ^ Grimaux, E. (1879). "Synthèse des dérivés uriques de la série de l'alloxane". Comptes rendus hebdomadaires des séances de l'Académie des Sciences. 88: 85–87.
- ^ Kenner, G.W.; Todd, Sir Alexander (1957). Elderfield, R.C., ed. Heterocyclic Compounds, Volume 6. New York: Wiley. hlm. 235.
- ^ Pinner, A. (1884). "Ueber die Einwirkung von Acetessigëther auf die Amidine". Berichte der Deutschen Chemischen Gesellschaft. A17: 2519–2520.
- ^ Pinner, A. (1885). "Ueber die Einwirkung von Acetessigëther auf die Amidine. Pyrimidine". Berichte der Deutschen Chemischen Gesellschaft. A18: 759–760.
- ^ Gabriel, S. (1900). "Pyrimidin aus Barbitursäure". Berichte der Deutschen Chemischen Gesellschaft. A33: 3666.
- ^ Lythgoe, B.; Rayner, L. S. (1951). "Substitution Reactions of Pyrimidine and its 2- and 4-Phenyl Derivatives". Journal of the Chemical Society: 2323–2329. doi:10.1039/JR9510002323.
- ^ Brown, D. J.; Evans, R.F.; Cowden, W. B.; Fenn, M. D. (1994). The Pyrimidines. New York: John Wiley & Sons. hlm. 5–6. ISBN 0-471-50656-7.
- ^ Brown, D. J.; Evans, R.F.; Cowden, W. B.; Fenn, M. D. (1994). The Pyrimidines. New York: John Wiley & Sons. hlm. 242–244. ISBN 0-471-50656-7.
- ^ Albert, Adrien (1968). Heterocyclic Chemistry, an Introduction. London: Athlone Press. hlm. 56–62.
- ^ Albert, Adrien (1968). Heterocyclic Chemistry, an Introduction. London: Athlone Press. hlm. 437–439.
- ^ Organic Syntheses, Coll. Vol. 4, p.182 (1963); Vol. 35, p.34 (1955) Link
- ^ Organic Syntheses, Coll. Vol. 4, p.336 (1963); Vol. 35, p.58 (1955) Link
- ^ Brown, D. J.; Evans, R.F.; Cowden, W. B.; Fenn, M. D. (1994). The Pyrimidines. New York: John Wiley & Sons. hlm. 4–8. ISBN 0-471-50656-7.
- ^ Nuevo M, Milam SN, Sandford SA, Elsila JE, Dworkin JP (2009). "Formation of uracil from the ultraviolet photo-irradiation of pyrimidine in pure H2O ices". Astrobiology. 9 (7): 683–695. Bibcode:2009AsBio...9..683N. doi:10.1089/ast.2008.0324. PMID 19778279.
- ^ Brown, D. J.; Evans, R.F.; Cowden, W. B.; Fenn, M. D. (1994). The Pyrimidines. New York: John Wiley & Sons. hlm. 241–2. ISBN 0-471-50656-7.
- ^ Brown, D. J.; Evans, R.F.; Cowden, W. B.; Fenn, M. D. (1994). The Pyrimidines. New York: John Wiley & Sons. hlm. 149–239. ISBN 0-471-50656-7.
- ^ Joule, John A.; Mills, Keith, ed. (2010). Heterocyclic Chemistry (edisi ke-5th). Oxford: Wiley. hlm. 253–4. ISBN 978-1-405-13300-5.