n-Butanol
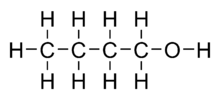
n-Butanol atau n-butil alkohol atau normal butanol adalah alkohol primer dengan struktur 4-karbon, dan memiliki rumus kimia C4H9OH. Isomernya antara lain isobutanol, 2-butanol, dan tert-butanol. Butanol adalah salah satu dari kelompok "alkohol fusel" (dari bahasa Jerman untuk "en: bad liquor"), yang memiliki lebih dari dua atom karbon dan mudah larut dalam air.
| |||
| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC (sistematis)
Butan-1-ol[1] | |||
| Nama lain
Butalkohol
Butanol | |||
| Penanda | |||
Model 3D (JSmol)
|
|||
| 3DMet | {{{3DMet}}} | ||
| Referensi Beilstein | 969148 | ||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| DrugBank | |||
| Nomor EC | |||
| Referensi Gmelin | 25753 | ||
| KEGG | |||
| MeSH | 1-Butanol | ||
PubChem CID
|
|||
| Nomor RTECS | {{{value}}} | ||
| UNII | |||
| Nomor UN | 1120 | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Sifat | |||
| C4H10O | |||
| Massa molar | 74,12 g·mol−1 | ||
| Penampilan | Tak berwarna, cairan kental | ||
| Bau | seperti pisang,[2] menyengat, manis beralkohol | ||
| Densitas | 0,81 g cm−3 | ||
| Titik lebur | −89,8 °C | ||
| Titik didih | 117,7 °C | ||
| 73 g L−1 at 25 °C | |||
| Kelarutan | sangat mudah larut dalam aseton bercampur dengan etanol, etil eter | ||
| log P | 0,839 | ||
| Tekanan uap | 6 mmHg (20 °C)[3] | ||
| Keasaman (pKa) | 16,10 | ||
| Indeks bias (nD) | 1,3993 (20 °C) | ||
| Viskositas | 2,573 mPa×s (at 25 °C) [4] | ||
| 1,66 D | |||
| Termokimia | |||
| Entropi molar standar (S |
225,7 J K−1 mol−1 | ||
| Entalpi pembentukan standar (ΔfH |
−328(4) kJ mol−1 | ||
| Entalpi pembakaran standar ΔcH |
−2.670(20) kJ mol−1 | ||
| Bahaya | |||
| Lembar data keselamatan | ICSC 0111 | ||
Klasifikasi UE (DSD) (usang)
|
|||
| Frasa-R | R10, R22, R37/38, R41, R67 | ||
| Frasa-S | S2, S7/9, S13, S26, S37/39, S46 | ||
| Titik nyala | 35 °C | ||
| 343 °C | |||
| Ambang ledakan | 1,45–11,25% | ||
| Dosis atau konsentrasi letal (LD, LC): | |||
LD50 (dosis median)
|
790 mg/kg (mencit, oral) | ||
LDLo (terendah tercatat)
|
3.484 mg/kg (kelinci, oral) 790 mg/kg (mencit, oral) 1700 mg/kg (anjing, oral)[5] | ||
LC50 (konsentrasi median)
|
9.221 ppm (mamalia) 8.000 ppm (mencit, 4 hr)[5] | ||
| Batas imbas kesehatan AS (NIOSH): | |||
PEL (yang diperbolehkan)
|
TWA 100 ppm (300 mg/m3)[3] | ||
REL (yang direkomendasikan)
|
C 50 ppm (150 mg/m3) [skin][3] | ||
IDLH (langsung berbahaya)
|
1.400 ppm[3] | ||
| Senyawa terkait | |||
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |||
| Referensi | |||
n-Butanol secara natural berada sebagai produk minor fermentasi gula dan karbohidrat lainnya,[6] dan terdapat dalam kebanyakan bahan makanan dan minuman.[7][8] Ini juga merupakan zat perisa buatan yang diizinkan di Amerika Serikat,[9] digunakan dalam mentega, krim, buah, rum, whiskey, es krim, kembang gula, dan produk bakeri.[10] Senyawa ini juga digunakan luas untuk produk-produk konsumen.[7]
Penggunaan terbesar n-butanol sebagai produk antara dalam industri, terutama pada pabrikasi butil asetat (suatu zat perisa buatan dan pelarut industrial). Ini merupakan suatu petrokimia, dibuat dari propilena dan biasanya dimanfaatkan oleh industri. Perkiraan jumlah produksi tahun 1997 adalah: AS 784.000 ton, Eropa Barat 575.000 ton, Jepang 225.000 ton.[8]
Produksi
suntingn-Butanol diproduksi secara industri dari bahan baku petrokimia propilena. Propilena diberi perlakuan hidroformilasi menjadi butiraldehida (proses okso) dengan keberadaan katalis homogen berbasis rhodium, mirip dengan katalis Wilkinson. Butiraldehida kemudian diberi perlakuan hidrogenasi untuk menghasilkan n-butanol.[8]
Penggunaan industrial
suntingn-Butanol merupakan produk antara pada produksi butil akrilat, butil asetat, dibutil ftalat, dibutil sebakat, dan butil ester lainnya,[11][12] butil eter seperti etilen glikol monobutil eter, di- dan trietilen glikol monobutil eter, dan butil eter asetat terkait. Penggunaan industrial lainnya mencakup pabrikasi farmasi, polimer, plastik piroksilin, ester herbisida, printing (misal: 2,4-D; 2,4,5-T)[13] dan butil xantat. Ini juga digunakan sebagai diluen/pereaksi dalam pembuatan urea–formaldehida dan melamin–resin formaldehida.[8]
Penggunaan lain
suntingn-Butanol digunakan sebagai bahan aktif dalam parfum dan sebagai pelarut untuk ekstraksi minyak atsiri.[11] n-Butanol juga digunakan sebagai pengekstrak pada industri antibiotika, hormon, dan vitamin;[11][12] pelarut untuk cat, pelapis, resin alami, getah, resin sintetis, pewarna, alkaloid, dan camphor.[11][12] Aplikasi minor lainnya antara lain sebagai zat pengembang dalam tekstil, komponen hidraulis dalam minyak rem, formulasi pembersih, penghilang gemuk pelumas,[7] sebagai komponen zat pengapung batuan,[13] dan sistem perlakuan kayu.[14]
n-Butanol telah diusulkan sebagai pengganti untuk minyak solar dan bensin. Senyawa ini diproduksi dalam jumlah kecil dari hampir seluruh fermentasi (lihat minyak fusel), tetapi spesies Clostridium memproduksi lebih banyak rendemen butanol, dan penelitian terkini sedang menjajagi untuk meningkatkan rendemen biobutanol dari biomassa.
Produksi atau, dalam beberapa kasus, penggunaan senyawa berikut berdampak pada eksposur n-butanol: kulit buatan, butil ester, semen karet, pewarna, perisa/pewarna buah, lak/pernis, industri film, film fotografi, jas hujan, parfum, plastik piroksilin, rayon, kacamata pengaman, dan pakaian tahan air.[7]
Keberadaan di alam
suntingLebah madu menggunakan n-butanol sebagai feromon siaga (En: alarm pheromone).
Keberadaan dalam makanan
suntingn-Butanol berada di alam sebagai hasil fermentasi karbohidrat dalam sejumlah minuman beralkohol, termasuk bir,[15] brandy anggur,[16] wine,[17] dan whisky.[18] Terdeteksi pula terdapat dalam uapan hop (Humulus lupulus),[19] nangka,[20] susu yang diberi perlakukan panas,[21] melon musk,[22] keju,[23] biji kacang,[24] dan nasi.[25] n-Butanol juga terbentuk selama deep fry minyak jagung, minyak biji kapas, trilinolein, dan triolein.[26]
n-Butanol digunakan sebagai bahan aktif dalam pemrosesan dan perisa buatan,[11] dan untuk ekstraksi protein bebas lemak dari kuning telor,[27] bahan perisa alami dan minyak sayur, produksi ekstrak hop untuk pembuatan bir, dan sebagai pelarut untuk menghilangkan pigmen dari konsentrat protein daun.[28]
Metabolisme dan toksisitas
suntingn-Butanol mudah diserap melalui saluran penceraan dan pernapasan, dan juga melalui kulit.[29] Senyawa ini dimetabolisme lengkap dalam vertebrata dengan jalur yang sama dengan metabolisme etanol: alkohol dehidrogenase mengubah n-butanol menjadi butiraldehida; kemudian dikonversi menjadi asam butirat oleh aldehida dehidrogenase. Asam butirat dapat dimetabolisme sempurna menjadi karbon dioksida dan air melalui jalur oksidasi-β. Dalam mencit, hanya 0,03% dari dosis oral 2.000 mg/kg yang dikeluarkan melalui urine.[30]
Toksisitas akut n-butanol relatif rendah, nilai LD50 oral adalah 790–4.360 mg/kg (mencit; nilai yang sebanding untuk etanol adalah 7.000–15.000 mg/kg).[8][31] Tidak ada kematian yang dilaporkan pada kasus menghirup senyawa ini dengan konsentrasi 8.000 ppm (mencit, terpapar selama 4-jam). Pada dosis sub-letal, n-butanol bertindak sebagai depresan pada sistem saraf pusat, mirip dengan etanol: satu penelitian pada mencit menunjukkan bahwa potensi intoksikasi n-butanol 6 kali lebih besar daripada etanol, penyebabnya kemungkinan akibat dari transformasinya yang lebih lambat dilakukan oleh alkohol dehidrogenase.[32]
n-Butanol adalah komponen alami dalam kebanyakan minuman beralkohol, walaupun dalam konsentrasi rendah (namun bervariasi).[33][34] Senyawa ini (bersama-sama dengan alkohol fusel) memiliki reputasi sebagai "memabukkan" yang parah, meskipun percobaan dalam model binatang menunjukkan bahwa tidak ditemukan bukti ini.[35] Dosis n-butanol yang tidak diketahui dikonsumsi oleh seorang pria berusia 47 tahun tanpa sejarah medis, menyebabkan sejumlah pengaruh kesehatan yang merugikan.
Bahaya lainnya
suntingCairan n-butanol, sebagaimana layaknya pelarut organik, sangat mengiritasi terhadap mata; sentuhan berulang dengan kulit dapat juga menyebabkan iritasi.[8] Senyawa ini diyakini memiliki pengaruh generik "defatting" (a.k.a: menghilangkan lemak dari makanan). Tidak ada sensitisasi kulit yang teramati. Iritasi jalur pernapasan hanya terjadi pada konsentrasi yang sangat tinggi (>2.400 ppm).[36]
Dengan titik sambar (en: flash point) 35 °C, n-butanol memiliki bahaya kebakaran moderat: sedikit lebih mudah terbakar daripada kerosin atau minyak disel, tetapi lebih susah terbakar daripada kebanyakan pelarut organik lainnya. Efek depresannya pada sistem saraf pusat (sama dengan intoksikasi etanol) merupakan bahaya potensial ketika bekerja dengan n-butanol dalam ruangan tertutup, meski ambang batas bau (0,2–30 ppm) jauh di bawah konsentrasi yang dapat mempengaruhi saraf.[36][37]
n-Butanol bertoksisitas rendah terhadap lingkungan perairan. Senyawa ini cepat terbiodegradasi dalam air, meskipun sekitar 83% bagian di udara di mana didegradasi oleh radikal hidroksil memiliki waktu paruh 1,2–2,3 hari. Memiliki potensial rendah mengalami bioakumulasi. Bahaya potensial pembuangan limbah n-butanol ke perairan adalah peningkatan kebutuhan oksigen kimia (en: chemical oxygen demand, COD) karena terkait dengan biodegradasinya.
Lihat juga
suntingPranala luar
sunting- (Inggris) International Chemical Safety Card 0111
- (Inggris) "NIOSH Pocket Guide to Chemical Hazards #0076". National Institute for Occupational Safety and Health (NIOSH).
- (Inggris) SIDS Initial Assessment Report for n-Butanol Diarsipkan 2015-09-24 di Wayback Machine. dari Organisation for Economic Co-operation and Development (OECD)
- (Inggris) IPCS Environmental Health Criteria 65: Butanols: four isomers
- (Inggris) IPCS Health and Safety Guide 3: 1-Butanol
Referensi
sunting- ^ "1-Butanol - Compound Summary". The PubChem Project. USA: National Center of Biotechnology Information.
- ^ [n-Butanol Product Information, The Dow Chemical Company, Form No. 327-00014-1001, page 1]
- ^ a b c d "NIOSH Pocket Guide to Chemical Hazards #0076". National Institute for Occupational Safety and Health (NIOSH).
- ^ Dubey, Gyan (2008). "Study of densities, viscosities, and speeds of sound of binary liquid mixtures of butan-1-ol with n-alkanes (C6, C8, and C10) at T = (298.15, 303.15, and 308.15) K". The Journal of Chemical Thermodynamics. 40 (2): 309–320. doi:10.1016/j.jct.2007.05.016.
- ^ a b "N-butyl alcohol". Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- ^ Hazelwood, Lucie A.; Daran, Jean-Marc; van Maris, Antonius J. A.; Pronk, Jack T.; Dickinson, J. Richard (2008), "The Ehrlich pathway for fusel alcohol production: a century of research on Saccharomyces cerevisiae metabolism", Appl. Environ. Microbiol. 74 (8): 2259–66, doi:10.1128/AEM.02625-07, PMC 2293160, PMID 18281432.
- ^ a b c d Butanols: four isomers, Environmental Health Criteria monograph No. 65, Geneva: World Health Organization, 1987, ISBN 92-4-154265-9.
- ^ a b c d e f n-Butanol Diarsipkan 2015-09-24 di Wayback Machine. (PDF), SIDS Initial Assessment Report, Geneva: United Nations Environment Programme, April 2005 .
- ^ 21 C.F.R. § 172.515; 42 FR 14491, Mar. 15, 1977, as amended.
- ^ Hall, R. L.; Oser, B. L. (1965), "Recent progress in the consideration of flavouring ingredients under the food additives amendement. III. Gras substances", Food Technol.: 151, cited in Butanols: four isomers, Environmental Health Criteria monograph No. 65, Geneva: World Health Organization, 1987, ISBN 92-4-154265-9.
- ^ a b c d e Mellan, I. (1950), Industrial Solvents, New York: Van Nostrand Reinhold, pp. 482–88 , cited in Butanols: four isomers, Environmental Health Criteria monograph No. 65, Geneva: World Health Organization, 1987, ISBN 92-4-154265-9 .
- ^ a b c Doolittle, A. K. (1954), The Technology of Solvents and Plasticizers, New York: Wiley, hlm. 644–45, cited in Butanols: four isomers, Environmental Health Criteria monograph No. 65, Geneva: World Health Organization, 1987, ISBN 92-4-154265-9 .
- ^ a b Monich, J. A. (1968), Alcohols: Their Chemistry, Properties, and Manufacture, New York: Chapman and Reinhold, cited in Butanols: four isomers, Environmental Health Criteria monograph No. 65, Geneva: World Health Organization, 1987, ISBN 92-4-154265-9.
- ^ ZA 7801031, Amundsen, J.; R. J. Goodwin & W. H. Wetzel, "Water-soluble pentachlorophenol and tetrachlorophenol wood-treating systems", diterbitkan tanggal 28 Feb. 1979.
- ^ Bonte, W. (1979), "Congener substances in German and foreign beers", Blutalkohol, 16: 108–24, cited in Butanols: four isomers, Environmental Health Criteria monograph No. 65, Geneva: World Health Organization, 1987, ISBN 92-4-154265-9 .
- ^ Schreier, Peter; Drawert, Friedrich; Winkler, Friedrich (1979), "Composition of neutral volatile constituents in grape brandies", J. Agric. Food Chem., 27 (2): 365–72, doi:10.1021/jf60222a031
- ^ Bonte, W. (1978), "Congener content of wine and similar beverages", Blutalkohol, 15: 392–404, cited in Butanols: four isomers, Environmental Health Criteria monograph No. 65, Geneva: World Health Organization, 1987, ISBN 92-4-154265-9 .
- ^ Postel, W.; Adam, L. (1978), "Gas chromatographic characterization of whiskey. III. Irish whiskey", Branntweinwirtschaft, 118: 404–7
- ^ Tressl, Roland; Friese, Lothar; Fendesack, Friedrich; Koeppler, Hans (1978), "Studies of the volatile composition of hops during storage", J. Agric. Food Chem., 26 (6): 1426–30, doi:10.1021/jf60220a036
- ^ Swords, G.; Bobbio, P. A.; Hunter, G. L. K. (1978), "Volatile constituents of jack fruit (Arthocarpus heterophyllus)", J. Food Sci., 43 (2): 639–40, doi:10.1111/j.1365-2621.1978.tb02375.x.
- ^ Jaddou, Haytham A.; Pavey, John A.; Manning, Donald J. (1978), "Chemical analysis of flavor volatiles in heat-treated milks", J. Dairy Res., 45 (3): 391–403, doi:10.1017/S0022029900016617.
- ^ Yabumoto, K.; Yamaguchi, M.; Jennings, W. G. (1978), "Production of volatile compounds by Muskmelon, Cucumis melo", Food Chem., 3 (1): 7–16, doi:10.1016/0308-8146(78)90042-0.
- ^ Dumont, Jean Pierre; Adda, Jacques (1978), "Occurrence of sesquiterpones in mountain cheese volatiles", J. Agric. Food Chem., 26 (2): 364–67, doi:10.1021/jf60216a037
- ^ Fisher, Gordon S.; Legendre, Michael G.; Lovgren, Norman V.; Schuller, Walter H.; Wells, John A. (1979), "Volatile constituents of southernpea seed [Vigna unguiculata (L.) Walp.]", J. Agric. Food Chem., 27 (1): 7–11, doi:10.1021/jf60221a040
- ^ Yajima, Izumi; Yanai, Tetsuya; Nakamura, Mikio; Sakakibara, Hidemasa; Habu, Tsutomu (1978), "Volatile flavor components of cooked rice", Agric. Biol. Chem., 42 (6): 1229–33, doi:10.1271/bbb1961.42.1229[pranala nonaktif permanen]
- ^ Chang, S. S.; Peterson, K. J.; Ho, C. (1978), "Chemical reactions involved in the deep-fat frying of foods", J. Am. Oil Chem. Soc.: 718–27
- ^ Meslar, Harry W.; White, Harold B., III (1978), "Preparation of lipid-free protein extracts of egg yolk", Anal. Biochem., 91 (1): 75–81, doi:10.1016/0003-2697(78)90817-5, PMID 9762085
- ^ Bray, Walter J.; Humphries, Catherine (1978), "Solvent fractionation of leaf juice to prepare green and white protein products", J. Sci. Food Agric., 29 (10): 839–46, doi:10.1002/jsfa.2740291003
- ^ Theorell, Hugo; Bonnichsen, Roger; Holtermann, Hugo; Sörensen, JöRgine Stene; Sörensen, Nils Andreas (1951), "Studies on Liver Alcohol Dehydrogenase I. Equilibria and Initial Reaction Velocities" (PDF), Acta. Chem. Scand., 5: 1105–26, doi:10.3891/acta.chem.scand.05-1105, diarsipkan dari versi asli (PDF) tanggal 2011-07-19, diakses tanggal 2015-12-07
- ^ Gaillard, D.; Derache, R. (1965), "Métabilisation de différents alcools présents dans les biossons alcooliques chez le rat", Trav. Soc. Pharmacol. Montpellier, 25: 541–62
- ^ Ethanol Diarsipkan 2012-01-04 di Wayback Machine. (PDF), SIDS Initial Assessment Report, Geneva: United Nations Environment Programme, August 2005 .
- ^ McCreery, N. J.; Hunt, W. A. (1978), "Physico-chemical correlates of alcohol intoxication", Neuropharmacology 17 (7): 451–61, doi:10.1016/0028-3908(78)90050-3, PMID 567755 .
- ^ Woo, Kang-Lyung (2005), "Determination of low molecular weight alcohols including fusel oil in various samples by diethyl ether extraction and capillary gas chromatography", J. AOAC Int. 88 (5): 1419–27, doi:10.5555/jaoi.2005.88.5.1419, PMID 16385992Woo, Kang-Lyung (2005), "Determination of low molecular weight alcohols including fusel oil in various samples by diethyl ether extraction and capillary gas chromatography", J. AOAC Int., 88 (5): 1419–27, doi:10.5555/jaoi.2005.88.5.1419, PMID 16385992.
- ^ Lachenmeier, Dirk W.; Haupt, Simone; Schulz, Katja (2008), "Defining maximum levels of higher alcohols in alcoholic beverages and surrogate alcohol products", Regul. Toxicol. Pharmacol., 50 (3): 313–21, doi:10.1016/j.yrtph.2007.12.008, PMID 18295386
- ^ Hori, Hisako; Fujii, Wataru; Hatanaka, Yutaka; Suwa, Yoshihide (2003), "Effects of fusel oil on animal hangover models", Alcohol Clin. Exp. Res., 27 (8 Suppl): 37S–41S, doi:10.1097/01.ALC.0000078828.49740.48, PMID 12960505
- ^ a b Wysocki, C. J.; Dalton, P. (1996), Odor and Irritation Thresholds for 1-Butanol in Humans, Philadelphia: Monell Chemical Senses Center, cited in n-Butanol Diarsipkan 2015-09-24 di Wayback Machine. (PDF), SIDS Initial Assessment Report, Geneva: United Nations Environment Programme, April 2005 .
- ^ Cometto-Muñiz, J. Enrique; Cain, William S. (1998), "Trigeminal and Olfactory Sensitivity: Comparison of Modalities and Methods of Measurement", Int. Arch. Occup. Environ. Health, 71 (2): 105–10, doi:10.1007/s004200050256, PMID 9580447

