Sitarabin
Sitarabin, juga dikenal sebagai sitosin arabinosida (ara-C), adalah obat kemoterapi yang digunakan untuk mengobati leukemia mieloid akut (AML), leukemia limfositik akut (ALL), leukemia mielogenus kronis (CML), dan limfoma non-Hodgkin. Obat ini diberikan melalui suntikan ke dalam vena, suntikan ke bawah kulit, atau ke dalam cairan serebrospinal. Ada formulasi liposomal yang memiliki bukti sementara tentang hasil yang lebih baik pada limfoma yang melibatkan meningen.[1]
| |
|---|---|
| |
| Nama sistematis (IUPAC) | |
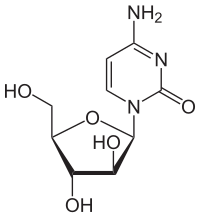
| 4-amino-1-[(2R,3S,4S,5R)-3,4-dihidroksi-5- (hidroksimetil)oksolan-2-il] pirimidin-2-ona | |
| Data klinis | |
| Nama dagang | Cytosar-U, Depocyt, dll |
| AHFS/Drugs.com | monograph |
| MedlinePlus | a682222 |
| Kat. kehamilan | D(AU) |
| Status hukum | ℞ Preskripsi saja |
| Rute | injeksi (infus, intratekal, atau subkutan) |
| Data farmakokinetik | |
| Bioavailabilitas | 20% (oral) |
| Ikatan protein | 13% |
| Metabolisme | Hati |
| Waktu paruh | bifasik: 10 menit, 1–3 jam |
| Ekskresi | Ginjal |
| Pengenal | |
| Nomor CAS | 147-94-4 |
| Kode ATC | L01BC01 |
| PubChem | CID 6253 |
| Ligan IUPHAR | 4827 |
| DrugBank | DB00987 |
| ChemSpider | 6017 |
| UNII | 04079A1RDZ |
| KEGG | D00168 |
| ChEBI | CHEBI:28680 |
| ChEMBL | CHEMBL803 |
| Data kimia | |
| Rumus | C9H13N3O5 |
| |
Efek samping yang umum termasuk supresi sumsum tulang, muntah, diare, masalah hati, ruam, pembentukan tukak di mulut, dan pendarahan. Efek samping serius lainnya termasuk kehilangan kesadaran, penyakit paru-paru, dan reaksi alergi. Penggunaan selama kehamilan dapat membahayakan bayi.[1] Sitarabin termasuk dalam keluarga obat antimetabolit dan analog nukleosida.[2] Obat ini bekerja dengan menghalangi fungsi DNA polimerase.[1]
Sitarabin dipatenkan pada tahun 1960 dan disetujui untuk penggunaan medis pada tahun 1969.[3] Obat ini masuk dalam Daftar Obat Esensial Organisasi Kesehatan Dunia.[4]
Sejarah
suntingIsolasi nukleotida yang mengandung arabinosa dari spons laut Karibia Cryptotheca crypta (sekarang Tectitethya crypta) bersama dengan kesadaran bahwa senyawa ini dapat bertindak sebagai terminator rantai sintesis DNA menyebabkan eksplorasi nukleotida baru ini sebagai terapi antikanker yang potensial.[5] Sitarabin pertama kali disintesis pada tahun 1959 oleh Richard Walwick, Walden Roberts, dan Charles Dekker di Universitas California, Berkeley.[6]
Kegunaan dalam medis
suntingSitarabin terutama digunakan dalam pengobatan leukemia mieloid akut, leukemia limfositik akut (ALL) dan limfoma,[7] di mana ia merupakan tulang punggung kemoterapi induksi.
Sitarabin juga memiliki aktivitas antivirus, dan telah digunakan untuk pengobatan infeksi virus herpes umum. Namun, sitarabin tidak terlalu selektif dalam pengaturan ini dan menyebabkan penekanan sumsum tulang dan efek samping berat lainnya. Oleh karena itu, ara-C bukanlah agen antivirus yang berguna pada manusia karena profil toksiknya.[8]
Sitarabin juga digunakan dalam studi sistem saraf untuk mengendalikan proliferasi sel neuroglia dalam kultur, jumlah sel neuroglia memiliki dampak penting pada neuron.[butuh rujukan] Baru-baru ini, sitarabin dilaporkan meningkatkan diferensiasi neuron yang kuat dan persisten dalam garis sel mirip neuron motorik NSC-34. Sitarabin bersifat permisif, tidak diperlukan, dan sebagian besar ireversibel dalam mempersiapkan sel NSC-34 untuk inisiasi dan regenerasi neurit setelah pemindahan mekanis.[9]
Efek samping
suntingToksisitas seperti pankreatitis, leukopenia, trombositopenia, anemia, gangguan gastrointestinal, stomatitis, konjungtivitis, pneumonitis, demam, dermatitis, dan eritrodisestesia palmar-plantar. Jarang terjadi, mielopati telah dilaporkan setelah pemberian Ara-C intratekal dosis tinggi atau sering.[10]
Untuk mencegah efek samping dan meningkatkan efisiensi terapi, berbagai turunan obat ini (termasuk asam amino, peptida, asam lemak, dan fosfat) telah dievaluasi, serta berbagai sistem penghantaran.[11]
Mekanisme kerja
suntingSitosin arabinosida menggabungkan basa sitosina dengan gula arabinosa. Ini adalah agen antimetabolik dengan nama kimia 1β-arabinofuranosilsitosin. Spons tertentu, tempat senyawa serupa awalnya ditemukan, menggunakan gula arabinosida untuk pertahanan kimia.[12] Sitosin arabinosida cukup mirip dengan deoksisitosin manusia untuk dimasukkan ke dalam DNA manusia, tetapi cukup berbeda sehingga membunuh sel. Sitosin arabinosida mengganggu sintesis DNA. Cara kerjanya adalah karena konversi cepatnya menjadi sitosin arabinosida trifosfat, yang merusak DNA saat siklus sel berada pada fase S (sintesis DNA). Oleh karena itu, sel yang membelah dengan cepat, yang membutuhkan replikasi DNA untuk mitosis, paling terpengaruh. Sitosin arabinosida juga menghambat DNA[13] dan RNA polimerase dan enzim nukleotida reduktase yang diperlukan untuk sintesis DNA. Sitarabin adalah yang pertama dari serangkaian obat kanker yang mengubah komponen gula nukleosida. Obat kanker lainnya memodifikasi basa tersebut.[14]
Sitarabin sering diberikan melalui infus intravena berkelanjutan, yang mengikuti eliminasi bifasik – laju pembersihan awal yang cepat diikuti oleh laju analog yang lebih lambat.[15] Sitarabin diangkut ke dalam sel terutama oleh hENT-1.[16]
Beberapa mekanisme resistensi telah dilaporkan.[17] Sitarabin dengan cepat dideaminasi oleh sitidina deaminase dalam serum menjadi turunan urasil yang tidak aktif. Sitarabin-5'-monofosfat dideaminasi oleh deoksisitidilat deaminase, yang menghasilkan analog uridin-5'-monofosfat yang tidak aktif.[18] Sitarabin-5'-trifosfat adalah substrat untuk SAMHD1.[19] Lebih jauh, SAMHD1 telah terbukti membatasi kemanjuran sitarabin pada pasien.[20]
Ketika digunakan sebagai antivirus, sitarabin-5'-trifosfat berfungsi dengan menghambat sintesis DNA virus.[21]
Pada tikus, Ara-CTP (sitarabin-5'-trifosfat) menghambat konsolidasi memori, tetapi tidak memori jangka pendek, dari peristiwa pengkondisian rasa takut kontekstual. Penghambatan konsolidasi memori diusulkan terjadi karena penghambatan oleh Ara-CTP pada jalur penyambungan ujung DNA nonhomolog.[22]
Merek
suntingBerikut merupakan merek sitarabin.[23]
- Cytosar-U
- Tarabine PFS (Pfizer)
- Depocyt (formulasi liposomal yang tahan lama)
- AraC
Referensi
sunting- ^ a b c "Cytarabine". The American Society of Health-System Pharmacists. Diarsipkan dari versi asli tanggal 11 June 2016. Diakses tanggal 8 December 2016.
- ^ British national formulary: BNF 69 (edisi ke-69). British Medical Association. 2015. hlm. 589. ISBN 9780857111562.
- ^ Fischer J, Ganellin CR (2006). Analogue-based Drug Discovery (dalam bahasa Inggris). John Wiley & Sons. hlm. 511. ISBN 9783527607495. Diarsipkan dari versi asli tanggal 2016-12-20.
- ^ World Health Organization (2019). World Health Organization model list of essential medicines: 21st list 2019. Geneva: World Health Organization. hdl:10665/325771 . WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
- ^ Schwartsmann G, Brondani da Rocha A, Berlinck RG, Jimeno J (April 2001). "Marine organisms as a source of new anticancer agents". The Lancet. Oncology. 2 (4): 221–225. doi:10.1016/s1470-2045(00)00292-8. PMID 11905767.
- ^ Sneader W (2005). Drug discovery: a history. New York: Wiley. hlm. 258. ISBN 0-471-89979-8.
- ^ Pigneux A, Perreau V, Jourdan E, Vey N, Dastugue N, Huguet F, Sotto JJ, Salmi LR, Ifrah N, Reiffers J (October 2007). "Adding lomustine to idarubicin and cytarabine for induction chemotherapy in older patients with acute myeloid leukemia: the BGMT 95 trial results". Haematologica. 92 (10): 1327–1334. doi:10.3324/haematol.11068 . PMID 18024370.
- ^ Lauter CB, Bailey EJ, Lerner AM (November 1974). "Assessment of cytosine arabinoside as an antiviral agent in humans". Antimicrobial Agents and Chemotherapy. 6 (5): 598–602. doi:10.1128/aac.6.5.598. PMC 444699 . PMID 15825312.
- ^ Vitale G, Amadio S, Liguori F, Volonté C (September 2024). "Empowering the NSC-34 cell line as a motor neuron model: cytosine arabinoside's action". Neural Regeneration Research. doi:10.4103/NRR.NRR-D-24-00034 . PMID 39314144 Periksa nilai
|pmid=(bantuan). - ^ Watterson J, Toogood I, Nieder M, Morse M, Frierdich S, Lee Y, Moertel CL, Priest JR (December 1994). "Excessive spinal cord toxicity from intensive central nervous system-directed therapies". Cancer. 74 (11): 3034–3041. doi:10.1002/1097-0142(19941201)74:11<3034::AID-CNCR2820741122>3.0.CO;2-O . PMID 7954266.
- ^ Chhikara BS, Parang K (December 2010). "Development of cytarabine prodrugs and delivery systems for leukemia treatment". Expert Opinion on Drug Delivery. 7 (12): 1399–1414. doi:10.1517/17425247.2010.527330. PMID 20964588.
- ^ Hall D (November 2019). "Sea Sponges: Pharmacies of the Sea". Smithsonian Ocean. Diakses tanggal 25 April 2023.
- ^ Perry MJ (2008). The Chemotherapy source book. Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins. hlm. 80. ISBN 978-0-7817-7328-7.
- ^ Feist P (April 2005). "A Tale from the Sea to Ara C". Diarsipkan dari versi asli tanggal 2007-03-06.
- ^ Liliemark JO, Gahrton G, Paul CY, Peterson CO (June 1987). "ara-C in plasma and ara-CTP in leukemic cells after subcutaneous injection and continuous intravenous infusion of ara-C in patients with acute nonlymphoblastic leukemia". Seminars in Oncology. 14 (2 Suppl 1): 167–171. PMID 3589691.
- ^ Clarke ML, Mackey JR, Baldwin SA, Young JD, Cass CE (2002). "The Role of Membrane Transporters in Cellular Resistance to Anticancer Nucleoside Drugs". Clinically Relevant Resistance in Cancer Chemotherapy. Cancer Treatment and Research. 112. hlm. 27–47. doi:10.1007/978-1-4615-1173-1_2. ISBN 978-1-4613-5428-4. PMID 12481710.
- ^ Shelton J, Lu X, Hollenbaugh JA, Cho JH, Amblard F, Schinazi RF (December 2016). "Metabolism, Biochemical Actions, and Chemical Synthesis of Anticancer Nucleosides, Nucleotides, and Base Analogs". Chemical Reviews. 116 (23): 14379–14455. doi:10.1021/acs.chemrev.6b00209. PMC 7717319 . PMID 27960273.
- ^ Drake JC, Hande KR, Fuller RW, Chabner BA (March 1980). "Cytidine and deoxycytidylate deaminase inhibition by uridine analogs". Biochemical Pharmacology. 29 (5): 807–811. doi:10.1016/0006-2952(80)90561-4. PMID 20227960.
- ^ Hollenbaugh JA, Shelton J, Tao S, Amiralaei S, Liu P, Lu X, Goetze RW, Zhou L, Nettles JH, Schinazi RF, Kim B (Jan 2017). "Substrates and Inhibitors of SAMHD1". PLOS ONE. 12 (1): e0169052. Bibcode:2017PLoSO..1269052H. doi:10.1371/journal.pone.0169052 . PMC 5207538 . PMID 28046007.
- ^ Schneider C, Oellerich T, Baldauf HM, Schwarz SM, Thomas D, Flick R, Bohnenberger H, Kaderali L, Stegmann L, Cremer A, Martin M, Lohmeyer J, Michaelis M, Hornung V, Schliemann C, Berdel WE, Hartmann W, Wardelmann E, Comoglio F, Hansmann ML, Yakunin AF, Geisslinger G, Ströbel P, Ferreirós N, Serve H, Keppler OT, Cinatl J (February 2017). "SAMHD1 is a biomarker for cytarabine response and a therapeutic target in acute myeloid leukemia" (PDF). Nature Medicine. 23 (2): 250–255. doi:10.1038/nm.4255. PMID 27991919.
- ^ Lemke TL, Williams DH, Foye WO (2002). Foye's principles of medicinal chemistry. Hagerstwon, MD: Lippincott Williams & Wilkins. hlm. 963. ISBN 0-683-30737-1.
- ^ Colón-Cesario M, Wang J, Ramos X, García HG, Dávila JJ, Laguna J, Rosado C, Peña de Ortiz S (May 2006). "An inhibitor of DNA recombination blocks memory consolidation, but not reconsolidation, in context fear conditioning". The Journal of Neuroscience. 26 (20): 5524–33. doi:10.1523/JNEUROSCI.3050-05.2006. PMC 6675301 . PMID 16707804.
- ^ Ogbomo H, Michaelis M, Klassert D, Doerr HW, Cinatl J (December 2008). "Resistance to cytarabine induces the up-regulation of NKG2D ligands and enhances natural killer cell lysis of leukemic cells". Neoplasia. 10 (12): 1402–1410. doi:10.1593/neo.08972. PMC 2586691 . PMID 19048119.