Sindrom metabolik
Sindrom metabolik atau sindrom resistansi insulin (bahasa Inggris: metabolic syndrome X, syndrome X, insulin resistance syndrome, Reaven's syndrome, CHAOS, equine metabolic syndrome, IRS) adalah kelompok penyakit yang setidaknya ads tiga dari lima penyakit berikut: obesitas perut, tekanan darah tinggi, gula darah tinggi, trigliserida serum tinggi, dan rendahnya serum lipoprotein densitas tinggi (HDL).
| Sindrom metabolik | |
|---|---|
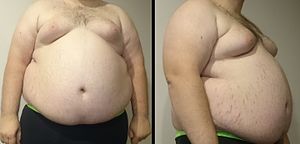 | |
| Seorang pria dengan obesitas sentral yang kentara, merupakan ciri khas sindrom metabolik. Bobotnya 182 kg, tinggi 185 cm, dan indeks massa tubuh (BMI) 53 (normal 18,5 hingga 25). | |
| Informasi umum | |
| Nama lain | Dismetabolik sindrom X |
| Spesialisasi | Endokrinologi |
Sindrom metabolik dihubungkan dengan risiko munculnya penyakit kardiovaskular dan diabetes melitus tipe 2.[1][2] Di Amerika Serikat, sekitar seperempat dari populasi orang dewasa memiliki sindrom metabolik, dan prevalensi meningkat dengan bertambahnya usia.[3][4]
Resistensi insulin, sindrom metabolik, dan prediabetes berkaitan erat satu sama lain dan memiliki aspek yang tumpang tindih. Sindrom ini diduga disebabkan oleh gangguan mendasar dari pemanfaatan dan penyimpanan energi. Saat ini sedang diteliti secara intensif dari penyebab sindrom ini.
Tanda dan gejala
suntingTanda kunci sindrom metabolik adalah obesitas sentral, juga dikenal sebagai visceral, adipositas pola pria atau berbentuk apel. Hal ini ditandai dengan akumulasi jaringan adiposa terutama di sekitar pinggang dan badan.[5] Tanda-tanda lain dari sindrom metabolik yaitu tekanan darah tinggi, penurunan kolesterol HDL serum puasa, peningkatan kadar trigliserida serum puasa, gangguan glukosa puasa, resistensi insulin, atau prediabetes. Penyakit terkait yaitu hiperurisemia; penyakit perlemakan hati non-alkoholik (terutama pada orang yang juga obesitas) yang berkembang menjadi penyakit perlemakan hati nonalkohol ; sindrom ovarium polikistik pada wanita, dan disfungsi ereksi pada pria; dan acanthosis nigricans.
Patofisiologi
suntingKejadian umum yaitu terjadinya lemak visceral, setelah itu adiposit (sel lemak) dari lemak visceral meningkatkan kadar TNF-α plasma dan mengubah kadar zat lain misalnya, adiponektin, resistin, dan PAI-1. TNF-α telah terbukti menyebabkan produksi sitokin inflamasi dan juga memicu pensinyalan sel melalui interaksi dengan reseptor TNF-α yang dapat menyebabkan resistensi insulin.[6] Percobaan dengan tikus yang diberi diet dengan sukrosa 33% telah diusulkan sebagai model untuk pengembangan sindrom metabolik. Sukrosa pertama-tama meningkatkan kadar trigliserida dalam darah, yang menginduksi lemak visceral dan akhirnya menghasilkan resistensi insulin. Perkembangan dari lemak visceral menjadi peningkatan TNF-α menjadi resistensi insulin memiliki beberapa kesamaan dengan perkembangan manusia dari sindrom metabolik. Peningkatan jaringan adiposa juga meningkatkan jumlah sel imun, yang berperan dalam peradangan. Peradangan kronis berkontribusi pada peningkatan risiko hipertensi, aterosklerosis, dan diabetes.[7]
Keterlibatan sistem endokannabinoid dalam pengembangan sindrom metabolik sangatlah besar.[8][9][10] Kelebihan produksi endokannabinoid dapat menyebabkan disfungsi sistem penghargaan[9] dan menyebabkan disfungsi eksekutif (misalnya melalaikan keterlambatan yang terganggu), yang pada gilirannya akan melangsungkan perilaku tidak sehat. Otak sangat penting dalam pengembangan sindrom metabolik, memodulasi karbohidrat perifer, dan metabolisme lipid.[8][9]
Sindrom metabolik dapat disebabkan oleh makan berlebih dengan gula atau fruktosa, terutama bersamaan dengan diet tinggi lemak.[11] Kelebihan pasokan asam lemak omega-6, terutama asam arakidonat (AA), merupakan faktor penting dalam patogenesis sindrom metabolik. Asam arakidonat (dengan prekursornya - asam linoleat ) berfungsi sebagai substrat untuk produksi mediator inflamasi yang dikenal sebagai eikosanoid, sedangkan senyawa yang mengandung asam arakidonat diasilgliserol (DAG) merupakan prekursor untuk endocannabinoid 2-arachidonoylglycerol ( 2-AG) sementara asam lemak amida hidrolase (FAAH) memediasi metabolisme anandamida menjadi asam arakidonat.[10][12] Anandamida juga dapat diproduksi dari N -asilfosfatidiletanolamin melalui beberapa jalur.[10] Anandamida dan 2-AG juga dapat dihidrolisis menjadi asam arakidonat, berpotensi menyebabkan peningkatan sintesis eikosanoid.[10]
Pengelolaan
suntingObat-obatan
suntingSecara umum, penyakit tunggal yang menyusun sindrom metabolik diobati secara terpisah.[13] Diuretik dan ACE inhibitor dapat digunakan untuk mengobati hipertensi. Berbagai obat kolesterol mungkin bermanfaat jika kolesterol LDL, trigliserida, dan atau kolesterol HDL tidak normal.
Diet
suntingDiet rendah karbohidrat mengurangi kadar glukosa darah, berkontribusi terhadap penurunan berat badan, dan mengurangi penggunaan beberapa obat yang mungkin diresepkan untuk sindrom metabolik.[14]
Referensi
sunting- ^ Kaur J (2014). "A comprehensive review on metabolic syndrome". Cardiology Research and Practice. 2014: 1–21. doi:10.1155/2014/943162. PMC 3966331 . PMID 24711954.
- ^ Felizola, Saulo JA (2015). "Ursolic acid in experimental models and human subjects: Potential as an anti-obesity/overweight treatment?". doi:10.13140/RG.2.1.4502.4804.[referensi medis tidak tepercaya?]
- ^ Falkner B, Cossrow ND (July 2014). "Prevalence of metabolic syndrome and obesity-associated hypertension in the racial ethnic minorities of the United States". Current Hypertension Reports. 16 (7): 449. doi:10.1007/s11906-014-0449-5. PMC 4083846 . PMID 24819559.
- ^ Beltrán-Sánchez H, Harhay MO, Harhay MM, McElligott S (August 2013). "Prevalence and trends of metabolic syndrome in the adult U.S. population, 1999–2010". Journal of the American College of Cardiology. 62 (8): 697–703. doi:10.1016/j.jacc.2013.05.064. PMC 3756561 . PMID 23810877.
- ^ "Metabolic Syndrome". Diabetes.co.uk. 15 January 2019.
- ^ Hotamisligil GS (June 1999). "The role of TNFalpha and TNF receptors in obesity and insulin resistance". Journal of Internal Medicine. 245 (6): 621–25. doi:10.1046/j.1365-2796.1999.00490.x. PMID 10395191.
- ^ Whitney, Ellie and Ralfes, R. Sharon. 2011. Understanding Nutrition. Wadsworth Cengage Learning: Belmont, CA
- ^ a b Gatta-Cherifi, Blandine; Cota, Daniela (2015). "Endocannabinoids and Metabolic Disorders". Endocannabinoids. Handbook of Experimental Pharmacology. 231. hlm. 367–91. doi:10.1007/978-3-319-20825-1_13. ISBN 978-3-319-20824-4. PMID 26408168.
The endocannabinoid system (ECS) is known to exert regulatory control on essentially every aspect related to the search for, and the intake, metabolism and storage of calories, and consequently it represents a potential pharmacotherapeutic target for obesity, diabetes and eating disorders. ... recent research in animals and humans has provided new knowledge on the mechanisms of actions of the ECS in the regulation of eating behavior, energy balance, and metabolism. In this review, we discuss these recent advances and how they may allow targeting the ECS in a more specific and selective manner for the future development of therapies against obesity, metabolic syndrome, and eating disorders.
- ^ a b c Vemuri VK, Janero DR, Makriyannis A (March 2008). "Pharmacotherapeutic targeting of the endocannabinoid signaling system: drugs for obesity and the metabolic syndrome". Physiology & Behavior. 93 (4–5): 671–86. doi:10.1016/j.physbeh.2007.11.012. PMC 3681125 . PMID 18155257.
The etiology of many appetitive disorders is characterized by a pathogenic component of reward-supported craving, be it for substances of abuse (including alcohol and nicotine) or food. Such maladies affect large numbers of people as prevalent socioeconomic and healthcare burdens. Yet in most instances drugs for their safe and effective pharmacotherapeutic management are lacking despite the attendant medical needs, collateral adverse physical and psychological effects, and enormous global market potential. The endocannabinoid signaling system plays a critical role in motivational homeostasis as a conduit for reward stimuli and a positive modulator of brain reward circuits. Endocannabinoid-system hyperactivity through CB1 receptor transmission is considered contributory to a range of appetitive disorders and, hence, is a major focus of contemporary pharmaceutical research.
- ^ a b c d Turcotte C, Chouinard F, Lefebvre JS, Flamand N (June 2015). "Regulation of inflammation by cannabinoids, the endocannabinoids 2-arachidonoyl-glycerol and arachidonoyl-ethanolamide, and their metabolites". Journal of Leukocyte Biology. 97 (6): 1049–70. doi:10.1189/jlb.3RU0115-021R. PMID 25877930.
- ^ Fukuchi S, Hamaguchi K, Seike M, Himeno K, Sakata T, Yoshimatsu H (June 2004). "Role of fatty acid composition in the development of metabolic disorders in sucrose-induced obese rats". Experimental Biology and Medicine. 229 (6): 486–93. doi:10.1177/153537020422900606. PMID 15169967.
- ^ Di Marzo V, Fontana A, Cadas H, et al. (Dec 1994). "Formation and inactivation of endogenous cannabinoid anandamide in central neurons". Nature (Submitted manuscript). 372 (6507): 686–91. Bibcode:1994Natur.372..686D. doi:10.1038/372686a0. PMID 7990962.
- ^ Srikanthan, K; Feyh, A; Visweshwar, H; Shapiro, J. I; Sodhi, K (2016). "Systematic Review of Metabolic Syndrome Biomarkers: A Panel for Early Detection, Management, and Risk Stratification in the West Virginian Population". International Journal of Medical Sciences. 13 (1): 25–38. doi:10.7150/ijms.13800. PMC 4716817 . PMID 26816492.
- ^ Feinman, R. D; Pogozelski, W. K; Astrup, A; Bernstein, R. K; Fine, E. J; Westman, E. C; Accurso, A; Frassetto, L; Gower, B. A (2015). "Dietary carbohydrate restriction as the first approach in diabetes management: Critical review and evidence base". Nutrition. 31 (1): 1–13. doi:10.1016/j.nut.2014.06.011. PMID 25287761. Parameter
|dead-url=Wilshiretidak valid (bantuan)