Reduksi Clemmensen
Reduksi Clemmensen adalah suatu reaksi kimia yang dideskripsikan sebagai reduksi keton (atau aldehida) menjadi alkana menggunakan amalgam seng dan asam klorida.[1][2][3] Reaksi ini dinamai dari Erik Christian Clemmensen, seorang kimiawan Denmark.[4]
| Reduksi Clemmensen | |
|---|---|
| Dinamai berdasarkan | Erik Christian Clemmensen |
| Jenis reaksi | Reaksi redoks organik |
| Pengenal | |
| Portal Organic Chemistry | clemmensen-reduction |
| ID ontologi RSC | RXNO:0000038 |
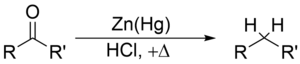
Reduksi Clemmensen secara khusus efektif dalam mereduksi aril-alkil keton,[5][6] seperti yang terbentuk dalam reaksi asilasi Friedel-Crafts. Dengan keton alifatik atau siklik, reduksi logam seng menjadi lebih efektif.[7]

Substrat yang digunakan haruslah tidak reaktif terhadap kondisi asam kuat dalam reduksi Clemmensen. Substrat yang sensitif terhadap asam sebaiknya direaksikan melalui reduksi Wolff–Kishner, yang mempergunakan kondisi basa kuat; lebih jauh, metode yang lebih sedang adalah melalui reduksi Mozingo. Atom oksigen terlepas dalam bentuk molekul air.

Namun, reaksi ini tidak cocok bagi substrat yang sensitif terhadap asam. Serta, gugus -COOH tidak dapat direduksi dengan metode ini. (gugus -COOH dapat direduksi dengan memberinya perlakuan menggunakan soda kapur dan kemudian dipanaskan).
Mekanisme reaksi
suntingTerlepas dari keantikan reaksi ini, mekanisme reduksi Clemmensen tetap tidak jelas. Karena sifat heterogen dari reaksi tersebut, studi mekanistik sangat sulit untuk dilakukan, dan hanya segelintir penelitian yang telah diungkapkan.[8][9] Mekanisme yang diajukan melibatkan zat antara organoseng, kemungkinan merupakan suatu karbenoid seng, baik sebagai spesies terpisah atau dengan fragmen organik yang terikat pada permukaan logam. Namun, alkohol terkait tidak diyakini sebagai zat antara, karena keadaan tergantung terhadap alkohol pada kondisi Clemmensen umumnya tidak menghasilkan produk alkana.[10]
Dua mekanisme yang kemudian disarankan ditampilkan berikut ini. Satu hal yang pasti:
- Reaksi berlangsung pada permukaan logam.
- Reaksi tidak berlanjut pada alkohol bebas, alkohol tersebut, yang sengaja ditambahkan sebagai substrat, tidak dapat direduksi.
- Reaksi ini merupakan transfer elektron secara berulang-ulang (bahasa Inggris: Single Transfer Electron; SET), dalam hal ini di mana kompleks seng-karbena terbentuk.
Mekanisme 1
suntingMekanisme 1 menyatakan bahwa oksigen dari gugus karbonil terprotonasi oleh asam. Ikatan seng-karbena kemudian terbentuk saat transfer elektron terjadi. Setelah protonasi yang diperbaharui dan transfer elektron, molekul air memisahkan diri dan kompleks seng-karbon yang terbentuk. Hidrokarbon dibebaskan melalui tahap protonasi sebanyak dua kali dan dengan transfer elektron sebanyak dua kali.
Mekanisme 2
suntingMekanisme 2 menyatakan bahwa sebuah elektron ditransfer pada karbon karbonil. Akibatnya, ikatan oksigen-seng terbentuk dan pada saat yang bersamaan anion karbon-radikal terbentuk. Oksigen ditransfer pada seng dengan cara transfer elektron ganda dan karbena karbon-seng terbentuk. Hidrokarbon kemudian dilepaskan seperti dijelaskan pada mekanisme 1, melalui protonasi dan transfer elektron.
Lihat pula
suntingReferensi
sunting- ^ Clemmensen, E. (1913). "Reduktion von Ketonen und Aldehyden zu den entsprechenden Kohlenwasserstoffen unter Anwendung von amalgamiertem Zink und Salzsäure". Chemische Berichte. 46: 1837–1843. doi:10.1002/cber.19130460292.
- ^ Clemmensen, E. (1914). "Über eine allgemeine Methode zur Reduktion der Carbonylgruppe in Aldehyden und Ketonen zur Methylengruppe". Chemische Berichte. 47: 51–63. doi:10.1002/cber.19140470108.
- ^ Clemmensen, E. (1914). "Über eine allgemeine Methode zur Reduktion der Carbonylgruppe in Aldehyden und Ketonen zur Methylengruppe. (III. Mitteilung.)". Chemische Berichte. 47: 681–687. doi:10.1002/cber.191404701107.
- ^ Biographies of Chemists, diakses tanggal 6 Februari 2007
- ^ (1943) "γ-Phenylbutyric acid". Org. Synth. 2. ; Vol. 15, p.64 (1935)
- ^ (1963) "Creosol". Org. Synth. 4. ; Vol. 33, p.17 (1953).
- ^ (1988) "Modified Clemmensen Reduction: Cholestane". Org. Synth. 6. ; Vol. 53, p.86 (1973).
- ^ Brewster, James H. (2002-05-01). "Reductions at Metal Surfaces. II. A Mechanism for the Clemmensen Reduction 1". Journal of the American Chemical Society (dalam bahasa Inggris). 76 (24): 6364–6368. doi:10.1021/ja01653a035.
- ^ Nakabayashi, Tadaaki (2002-05-01). "Studies on the Mechanism of Clemmensen Reduction. I. The Kinetics of Clemmensen Reduction of p-Hydroxyacetophenone". Journal of the American Chemical Society (dalam bahasa Inggris). 82 (15): 3900–3906. doi:10.1021/ja01500a029.
- ^ Martin, Elmore L. (2004-01-01). The Clemmensen Reduction (dalam bahasa Inggris). John Wiley & Sons,Inc. doi:10.1002/0471264180.or001.07. ISBN 9780471264187.
Ulasan
sunting- Martin, E. L. (1942). "The Clemmensen reduction". Org. React. 1: 155.
- Buchanan, J. G. St. C.; Woodgate, P. D. (1969). "The Clemmensen reduction of difunctional ketones". Quarterly Reviews, Chemical Society. 23: 522. doi:10.1039/QR9692300522.
- Vedejs, E. (1975). "Clemmensen reduction of ketones in anhydrous organic solvents". Org. React. 22: 401–422.
- Yamamura, S.; Nishiyama, S. (1991). "1.13.2.2 Clemmensen reduction". Comprehensive Organic Synthesis. 8: 309–313.