Adisi aldol Mukaiyama
Artikel ini perlu diterjemahkan dari bahasa Inggris ke bahasa Indonesia. |
Adisi aldol Mukaiyama adalah sejenis reaksi organik yang termasuk dalam reaksi aldol antara silil enol eter dengan aldehida yang dikatalisasi oleh asam Lewis. Pemilihan reaktan-reaktan ini mengizinkan reaksi aldol silang antara aldehida dengan keton atau aldehida yang berbeda lainnya tanpa menyebabkan terjadinya swakondensasi aldehida. Oleh karena itu, reaksi ini digunakan secara ekstensif dalan sintesis organik. Pada ruang lingkup awalnya, asam Lewis yang digunakan memiliki kadar stoikiometrik, tetapi terdapat juga sistem katalitik yang sebenarnya. Reaksi ini juga dioptimalkan untuk sintesis asimetrik.
Reaksi yang dipublikasikan oleh Teruaki Mukaiyama pada tahun 1973[1] adalah reaksi antara silil enol eter dari sikloheksanon dengan benzaldehida dengan satu ekuivalen titanium tetraklorida dalam diklorometana. Pada suhu kamar, reaksi ini menghasilkan campuran diastereomer treo (63%) dan eritro (19%) β-hidroksiketon serta 6% produk kondensasi enon eksosiklik.
Jurnal selanjutnya pada tahun 1974[2] berkutat pada reaksi antara isopropenil asetat (aduk aseton dan asam asetat) dengan benzaldehida dengan berbagai asam Lewis (seperti aluminium klorida, timah tetraklorida, dan boron trifluorida), tetapi terdapat banyak reaksi samping yang berkompetisi dengan pembentukan hidroksiketon. Kemudian pada jurnal lainnya pada tahun yang sama[3] kembali ke silil enol eter namun temperatur reaksinya -78 °C, menghasilkan diastereoselektivitas yang diinginkan.
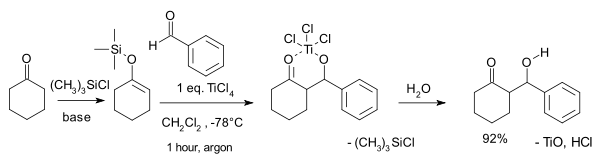
Gugus trimetilsilil mengaktivasi enol menjadi nukleofil dan produk reaksi awalnya adalah kelat titanium yang akan terurai pada proses hidrolisis.
Reaksi yang umum melibatkan dua keton, yakni antara asetofenon sebagai enol dengan aseton:[4]

Reaksi keton jenis ini memerlukan temperatur reaksi yang lebih tinggi.
Jangkauan
suntingMukaiyama menggunakan reaksi ini pada sintesis total taksol (1999),[5][6] reaksi pertama dengan ketena silil asetal dan magnesium bromida yang berlebih:
reaksi kedua dengan ligan kiral amina dan katalis garam triflat:
Referensi
sunting- ^ New aldol type reaction Teruaki Mukaiyama, Koichi Narasaka and Kazuo Banno Chemistry Letters Vol.2 (1973), No.9 pp.1011-1014 DOI:10.1246/cl.1973.1011
- ^ REACTION OF ENOL ACETATE WITH ACETAL AND CARBONYL COMPOUND IN THE PRESENCE OF LEWIS ACID Teruaki Mukaiyama, Toshio Izawa and Kazuhiko Saigo Chemistry Letters Vol.3 (1974), No.4 pp.323-326 DOI:10.1246/cl.1974.323
- ^ Reactions of silyl enol ethers with carbonyl compounds activated by titanium tetrachloride Teruaki Mukaiyama, Kazuo Banno, and Koichi Narasaka J. Am. Chem. Soc.; 1974; 96(24) pp 7503–7509; doi:10.1021/ja00831a019
- ^ Organic Syntheses, Coll. Vol. 8, p.323 (1993); Vol. 65, p.6 (1987). http://www.orgsynth.org/orgsyn/pdfs/CV8P0323.pdf
- ^ Asymmetric Total Synthesis of Taxol Teruaki Mukaiyama, Isamu Shiina, Hayato Iwadare, Masahiro Saitoh, Toshihiro Nishimura, Naoto Ohkawa, Hiroki Sakoh, Koji Nishimura, Yu-ichirou Tani, Masatoshi Hasegawa, Koji Yamada, Katsuyuki Saitoh Chem. Eur. J. 1999, 5, No. 1 DOI:10.1002/(SICI)1521-3765(19990104)5:1<121::AID-CHEM121>3.0.CO;2-O
- ^ TBS = t-butyldimethylsilyl, Bn = benzyl, PMB = p-methoxybenzyl ether