Isomerisme cis–trans
Dalam kimia, isomerisme cis-trans atau isomerisme geometrik atau isomerisme konfigurasi adalah sebuah bentuk stereoisomerisme yang menjelaskan orientasi gugus-gugus fungsi dalam sebuah molekul. Secara umum, isomer seperti ini mempunyai ikatan rangkap yang tidak dapat berputar. Selain itu, isomer ini juga muncul dikarenakan struktur cincin molekul yang menyebabkan perputaran ikatan sangat terbatas.


Istilah "isomerisme geometrik" adalah istilah lama yang sudah tidak digunakan lagi dan merupakan sinonim dari "isomerisme cis-trans". Ia kadang-kadang juga merupakan sinonim untuk stereoisomerisme umum (misalnya isomerisme optis); istilah yang tepat untuk stereoisomerisme non-optis adalah diastereomerisme.
Terdapat dua bentuk isomer cis-trans, yakni cis dan trans. Ketika gugus substituen berorientasi pada arah yang sama, diastereomer ini disebut sebagai cis, sedangkan ketika subtituen berorientasi pada arah yang berlawanan, diastereomer ini disebut sebagai trans. Contoh molekul hidrokarbon yang menunjukkan isomerisme cis-trans adalah 2-butena.
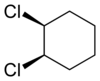
Senyawa alisiklik juga dapat menunjukkan isomerisme cis-trans. Sebagai contoh isomer geometrik yang disebabkan oleh struktur cincin, perhatikan 1,2-diklorosikloheksana:
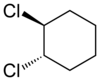 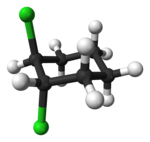 |
|
| trans-1,2-diklorosikloheksana | cis-1,2-diklorosikloheksana |
Sifat fisik cis vs trans
suntingIsomer cis dan isomer trans sering kali memiliki sifat-sifat fisika yang berbeda. Perbedaan antara isomer pada umumnya disebabkan oleh perbedaan bentuk molekul atau momen dipol secara keseluruhan. Perbedaan ini dapatlah sangat kecil, seperti yang terlihat pada titik didih alkena berantai lurus 2-pentena (titik didih isomer trans 36 °C dan isomer cis 37 °C).[1] Perbedaan isomer cis dan trans juga dapat sangat besar, seperti pada kasus siklooktena. Isomer cis senyawa ini memiliki titik didih 145 °C,[2] sedangkan isomer transnya 75 °C.[3] Perbedaan yang sangat besar antara kedua isomer siklooktena disebabkan oleh terikan cincin yang besar untuk trans-siklooktena, yang juga menyebabkannya kurang stabil dibandingkan isomer cis. Bahkan, kedua isomer asam 2-butenadioat memiliki sifat-sifat dan reaktivitas yang sangat berbeda sehingga mempunyai nama yang berbeda pula. Isomer cisnya di sebuah asam maleat, sedangkan isomer transnya di sebuah asam fumarat. Polaritas merupakan faktor kunci yang menentukan titik didih relatif senyawa karena ia akan meningkatkan gaya antar molekul, sedangkan simetri merupakan faktor kunci yang menentukan titik leleh relatif karena ia mengizinkan penataan molekul yang lebih baik pada bentuk padat. Oleh karena itu, trans-alkena yang kurang polar dan lebih simetris cenderung memiliki titik didih yang lebih rendah dan titik leleh yang lebih tinggi. Sebaliknya cis-alkena secara umum memiliki titik didih yang lebih tinggi dan titik leleh yang lebih rendah.
Notasi E/Z
suntingSistem penamaan isomer cis/trans tidaklah efektif ketika terdapat lebih dari dua substituen pada ikatan ganda. Notas E/Z dapat digunakan untuk kasus seperti ini. Z (berasal dari Bahasa Jerman zusammen) berarti bersama dan berkorespondensi dengan istilah cis; E (berasal dari Bahasa Jerman entgegen) berarti berlawanan dan berkorespondensi dengan istilah trans.
Sebuah konfifurasi molekul disebut E atau Z tergantung pada kaidah prioritas Cahn-Ingold-Prelog (nomor atom yang lebih tinggi memiliki prioritas lebih tinggi). Untuk setiap atom yang melekat pada ikatan ganda, diperlukan penentuan substituen mana yang memiliki prioritas lebih tinggi. Jika dua substituen berprioritas leih tinggi berada pada sisi yang sama, susunan ini disebut Z; sedangkan jika berlawanan, susunan ini disebut E.
Pranalua luar
sunting- Definisi IUPAC dari "stereoisomerisme" Diarsipkan 2009-12-29 di Wayback Machine.
- Definisi IUPAC dari "isomerisme geometrik" Diarsipkan 2009-09-07 di Wayback Machine.
- Definisi IUPAC dari "isomer cis-trans" Diarsipkan 2010-08-21 di Wayback Machine.
Lihat pula
suntingReferensi
sunting- ^ Chemicalland values
- ^ "Akros data". Diarsipkan dari versi asli tanggal 2007-10-08. Diakses tanggal 2008-09-26.
- ^ Organic Syntheses, Coll. Vol. 5, p.315 (1973); Vol. 49, p.39 (1969) Link