Asam kloroplatinat
Asam kloroplatinat juga dikenal sebagai asam heksakloroplatinat) adalah senyawa anorganik dengan rumus [H3O]2[PtCl6](H2O)x (0 ≤ x ≤ 6). Berbentuk padatan merah, ia merupakan sumber komersial yang penting dari platina, biasanya sebagai larutan berair. Meskipun sering ditulis dengan singkatan sebagai H2PtCl6, ia adalah garam hidronium (H3O+) dari anion heksakloroplatinat (PtCl2−6).[1][2][3] Asam heksakloroplatinat bersifat sangat higroskopis.
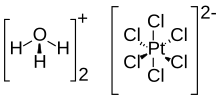
| |

| |

| |
| Nama | |
|---|---|
| Nama IUPAC
Dihidronium heksakloroplatinat(2–)
| |
| Nama lain
Asam heksakloroplatinat
| |
| Penanda | |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| ChemSpider | |
| Nomor EC | |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
| UNII | |
| Nomor UN | 2507 |
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| H6Cl6O2Pt | |
| Massa molar | 409,81 g/mol |
| Penampilan | Padatan coklat kemerahan |
| Densitas | 2.431 g/cm3 |
| Titik lebur | 60 °C (140 °F; 333 K) |
| Titik didih | terurai |
| sangat larut | |
| Struktur | |
| Anti-fluorit | |
| oktahedral | |
| 0 D | |
| Bahaya | |
| Lembar data keselamatan | External MSDS |
| Piktogram GHS |    
|
| Keterangan bahaya GHS | {{{value}}} |
| H301, H314, H317, H334 | |
| P260, P261, P264, P270, P272, P280, P285, P301+310, P301+330+331, P302+352, P303+361+353, P304+340, P304+341, P305+351+338, P310, P321, P330, P333+313, P342+311, P363, P405, P501 | |
| Senyawa terkait | |
Anion lain
|
Asam heksakloropaladik |
Kation lainnya
|
Kalium heksakloroplatinat, Amonium heksakloroplatinat, Rubidium heksakloroplatinat, Sesium heksakloroplatinat |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Produksi
suntingAsam heksakloroplatinat dapat diproduksi melalui berbagai metode. Yang paling umum dari metode ini melibatkan pelarutan platina dalam air raja. Metode lain termasuk memaparkan suspensi berair partikel platina ke gas klorin, atau melalui elektrolisis.
Ketika diproduksi menggunakan rute air raja, asam heksakloroplatinat diperkirakan muncul dengan persamaan berikut:[4][5]
Larutan berwarna jingga/merah yang dihasilkan dapat diuapkan hingga menghasilkan kristal berwarna merah kecoklatan. Beberapa penulis memperkirakan bahwa asam heksakloroplatinat yang dihasilkan menggunakan metode ini terkontaminasi dengan nitrosonium heksakloroplatinat. Literatur yang lebih baru menunjukkan bahwa ini bukan masalahnya, dan setelah asam nitrat dihilangkan, sampel yang disiapkan melalui metode ini tidak mengandung nitrogen yang terdeteksi.
Metode alternatif telah diselidiki dan dijelaskan, seringkali dimotivasi oleh penghindaran kontaminasi nitrogen.[6]
Reaksi
suntingKetika dipanaskan, asam heksakloroplatinat akan terurai menjadi platina(IV) klorida.[1]
Aplikasi
suntingDeterminasi kalium
suntingAsam kloroplatinat dipopulerkan sebagai analisis kuantitatif kalium. Kalium secara selektif diendapkan dari larutan sebagai kalium heksakloroplatinat. Determinasi dilakukan dalam larutan alkohol 85% (v/v) dengan ion platinat berlebih, dan produk yang diendapkan kemudian ditimbang. Kalium dapat dideteksi sebagai larutan seencer 0,02% hingga 0,2% (m/v).[7]
Metode determinasi kalium ini lebih menguntungkan dibandingkan dengan metode natrium kobaltinitrit yang digunakan sebelumnya, karena memerlukan reaksi pengendapan tunggal.[7] Analisis gravimetri produk yang diendapkan telah digantikan oleh metode analisis instrumental modern, seperti elektrode selektif ion, fotometri api, ICP-AES atau ICP-MS.
Pemurnian platina
suntingSetelah ditambah dengan garam amonium, seperti amonium klorida, asam kloroplatinat berubah menjadi amonium heksakloroplatinat, yang mengendap sebagai padatan.[4] Setelah dipanaskan dalam atmosfer hidrogen, garam amonium berubah menjadi unsur platina. Platina sering diisolasi dari bijih atau didaur ulang dari residu menggunakan metode ini.[8]
Katalisis
suntingSeperti banyak senyawa platina lain, asam kloroplatinat adalah katalis (atau prakatalis) untuk hidrogenasi dan reaksi terkait. Seperti yang pertama kali dilaporkan oleh John Speier dan rekan-rekannya dari Dow Corning, senyawa, ini mengkatalisis penambahan hidrosilan ke olefin, yaitu hidrosilasi. Reaksi demonstrasi awal menggunakan larutan isopropanol triklorosilana (SiHCl3) dengan pentena. Pekerjaan sebelumnya pada penambahan silan ke alkena membutuhkan reaksi radikal yang tidak efisien.[9][10] Seperti halnya dengan katalis Karstedt, katalis Speier juga digunakan secara luas untuk hidrosilasi, kelemahan utamanya adalah sifat deliquescent dari katalis tersebut.[11]
Secara umum disepakati bahwa asam kloroplatinat adalah prekursor untuk katalis yang sebenarnya. Kemungkinan peran platina koloid atau kompleks nol-valensi juga telah dipertimbangkan.[12]
Senyawa terkait
suntingAsam kloroplatinat yang dibuat dari air raja diusulkan untuk mengandung nitrosonium heksakloroplatinat, (NO)2PtCl6. Nitrosonium heksakloroplatinat diperoleh dengan reaksi nitrosil klorida (NOCl) dan logam platina.[13] Telah diketahui jika nitrosonium heksakloroplatinat bereaksi hebat dengan air dan asam klorida, membuat kontaminasi asam kloroplatinat yang dibuat dengan air raja dengan nitrosonium heksakloroplatinat tidak mungkin terjadi.
Referensi
sunting- ^ a b Schweizer, A. E.; Kerr, G. T. (1978). "Thermal Decomposition of Hexachloroplatinic Acid". Inorganic Chemistry. 17 (8): 2326–2327. doi:10.1021/ic50186a067.
- ^ Holleman; Wiberg (2001). Inorganic Chemistry (edisi ke-1). New York: Academic Press. ISBN 0-12-352651-5.
- ^ Greenwood, N. N.; Earnshaw, A. (1997). Chemistry of the Elements (edisi ke-2). New York: Elsevier Butterworth-Heinemann. ISBN 978-0-7506-3365-9.
- ^ a b Kauffman, George B. (1967). "Ammonium Hexachloroplatinate(IV)". Inorganic Syntheses. 9: 182–185. doi:10.1002/9780470132401.ch51. ISBN 9780470132401.
- ^ Grube, H. (1963). "Hexachloroplatinic(IV) Acid". Dalam Brauer, G. Handbook of Preparative Inorganic Chemistry. 2 (edisi ke-2). New York: Academic Press. hlm. 1569.
- ^ Rudnick, Paul; Cooke, R. D. (1917). "The Preparation of Hydrochloroplatinic Acid by Means of Hydrogen Peroxide". J. Am. Chem. Soc. 39 (4): 633–635. doi:10.1021/ja02249a011.
- ^ a b Smith, G. Frederick; Gring, J. L. (1933). "The Separation and Determination of the Alkali Metals Using Perchloric Acid. V. Perchloric Acid and Chloroplatinic Acid in the Determination of Small Amounts of Potassium in the Presence of Large Amounts of Sodium". J. Am. Chem. Soc. 55 (10): 3957–3961. doi:10.1021/ja01337a007.
- ^ Cotton, S. A. (1997). Chemistry of Precious Metals. London: Chapman and Hall. ISBN 0-7514-0413-6.
- ^ Speier, J. L.; Webster, J. A.; Barnes, G. H. (1957). "The Addition of Silicon Hydrides to Olefinic Double Bonds. Part II. The Use of Group VIII Metal Catalysts". J. Am. Chem. Soc. 79 (4): 974–979. doi:10.1021/ja01561a054.
- ^ Saam, John C.; Speier, John L. (1958). "The Addition of Silicon Hydrides to Olefinic Double Bonds. Part III. The Addition to Non-terminal Olefins in the Presence of Chloroplatinic Acid". J. Am. Chem. Soc. 80 (15): 4104–4106. doi:10.1021/ja01548a073.
- ^ Sibi, Mukund P. (2001). "Hydrogen Hexachloroplatinate(IV)". Encyclopedia of Reagents for Organic Synthesis, 8 Volume Set. Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons. doi:10.1002/047084289X.rh038. ISBN 0471936235.
- ^ Lewis, L. N.; Sy, K. G.; Bryant, G. L.; Donahue, P. E. (1991). "Platinum-catalyzed hydrosilylation of alkynes". Organometallics. 10 (10): 3750–3759. doi:10.1021/om00056a055.
- ^ Moravek, R. T.; Kauffman, G. B.; Mahmood, T. (1967). "Nitrosyl Hexachloroplatinate(IV)". Inorganic Syntheses. 9: 217–220. doi:10.1002/9780470132555.ch63. ISBN 9780470132555.