Asam klorit
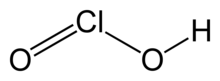
Asam klorit adalah suatu senyawa anorganik dengan rumus kimia HClO2. Senyawa ini adalah asam lemah yang mengandung atom klorin dengan bilangan oksidasi +3. Zat murni senyawa ini bersifat tidak stabil, mudah mengalami disproporsionasi membentuk asam hipoklorit (bilangan oksidasi Cl adalah +1) dan asam klorat (bilangan oksidasi Cl adalah +5):
| |

| |
| Nama | |
|---|---|
| Nama IUPAC
Asam klorit, Asam klorat(III)
| |
| Penanda | |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| ChEBI | |
| ChemSpider | |
| Nomor EC | |
| KEGG | |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| HClO2 | |
| Massa molar | 68.46 g/mol |
| Keasaman (pKa) | 1.96 |
| Basa konjugat | Klorit |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
- 2 HClO2 → HClO + HClO3
Meskipun asam ini sulit diperoleh dalam keadaan murninya, basa konjugasinya, klorit, yang berasal dari asam ini bersifat stabil. Salah satu contoh garam dari anion ini adalah natrium klorit. Garam ini dan garam terkait terkadang digunakan dalam produksi klorin dioksida.
Preparasi
suntingHClO2 dapat dibuat melalui reaksi barium atau timbal klorit dan asam sulfat encer:
- Ba(ClO2)2 + H2SO4 → BaSO4 + 2 HClO2
- Pb(ClO2)2 + H2SO4 → PbSO4 + 2 HClO2
Stabilitas
suntingAsam klorit adalah zat pengoksidasi yang kuat, meskipun kecenderungannya untuk disproporsionasi berlawanan dengan potensial pengoksidasinya.
Klorin adalah satu-satunya halogen yang membentuk asam yang dapat diisolasi dengan rumus HXO2.[1] Baik asam bromit maupun asam iodit tidak pernah diisolasi. Beberapa garam dari asam bromit, bromit, diketahui, tetapi tidak ada garam iodit yang berhasil diisolasi.[1]
Lihat pula
suntingReferensi
sunting- ^ a b Egon Wiberg, Arnold Frederick Holleman (2001) Inorganic Chemistry, Elsevier ISBN 0-12-352651-5