Tautomerisme keto–enol
Dalam kimia organik, tautomerisme keto–enol merujuk pada kesetimbangan kimia antara bentuk keto (suatu keton atau aldehida) dan bentuk enol (suatu alkohol).[1] Bentuk enol dan keto dikatakan merupakan tautomer satu sama lain. Interkonversi dua bentuk tersebut melibatkan perpindahan atom hidrogen alfa dan penataan ulang elektron yang terikat; karenanya, isomerisme dapat dikelompokkan sebagai tautomerisme.[2]
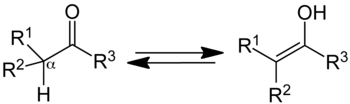
Bentuk keto (kiri); bentuk enol (kanan).
Suatu senyawa yang mengandung gugus karbonil (C=O) normalnya berada dalam kesetimbangan yang cepat dengan tautomer enolnya, yang mengandung sepasang atom karbon yang terikat rangkap dua pada suatu gugus hidroksil (−OH), C=C-OH. Bentuk keto mendominasi kesetimbangan untuk sebagian besar keton.[3] Meskipun demikian, bentuk enol penting untuk beberapa reaksi. Zat antara yang terdeprotonasi dalam interkonversi dua bentuk tersebut, yang disebut sebagai anion enolat, penting dalam kimia karbonil, sebagian besar karena anion tersebut adalah nukleofil yang kuat.
Biasanya, kesetimbangan kimia tautomerisasi keto–enol digerakkan secara termodinamika, dan pada suhu kamar kesetimbangan tersebut sangat mendukung pembentukan bentuk keto. Contoh klasik untuk mendukung bentuk keto dapat dilihat dalam keseimbangan antara vinil alkohol dan asetaldehida (K = [enol]/[keto] ≈ 3 × 10−7). Namun, dilaporkan bahwa dalam kasus vinil alkohol, pembentukan bentuk enol yang distabilkan dapat dicapai dengan mengendalikan konsentrasi air dalam sistem dan memanfaatkan daya tarik kinetik dari deuterium yang dihasilkan efek isotop kinetik (kH+/kD+ = 4.75, kH2O/kD2O = 12). Stabilisasi deuterium dapat dicapai melalui hidrolisis prekursor ketena dengan adanya sedikit air berat (D2O) berlebih secara stoikiometris. Studi menunjukkan bahwa proses tautomerisasi terhambat secara signifikan pada suhu ambien ( kt ≈ 10−6 M/s), dan waktu paruh dari bentuk enol dapat dengan mudah ditingkatkan sehingga t1/2 = 42 menit untuk kinetika hidrolisis orde pertama.[4]
Mekanisme
suntingKonversi enol ke bentuk keto yang dikatalisis oleh asam dihasilkan oleh dua tahap mekanisme dalam larutan asam berair.[5] Karenanya, penting bahwa atom karbon alfa (atom karbon yang paling dekat dengan gugus fungsional) mengandung setidaknya satu atom hidrogen yang dikenal sebagai atom hidrogen alfa. Atom hidrogen alfa ini juga harus diposisikan sedemikian rupa sehingga dapat sejajar dengan orbital pi antiikatan dari gugus karbonil. Hiperkonjugasi dari ikatan ini dengan ikatan C–H pada atom karbon alfa mengurangi densitas elektron dari ikatan C–H dan melemahkannya, membuat atom hidrogen alfa lebih asam. Ketika atom hidrogen alfa tidak sejajar dengan orbital pi, misalnya dalam adamantanona atau keton polisiklik lainnya, enolisasi tidak mungkin atau sangat lambat terjadi.[6][7]
Pada tahap pertama mekanisme ini, elektron pada ikatan rangkap C=C enol disumbangkan ke ion hidronium (H3O+). Adisi ini mengikuti aturan Markovnikov, dengan demikian proton ditambahkan ke atom karbon dengan atom hidrogen yang lebih terikat. Ini adalah tahapan serentak dengan atom oksigen dalam gugus hidroksil yang menyumbangkan elektron untuk menghasilkan gugus karbonil pada akhirnya.[8][9]
Aturan Erlenmeyer
suntingSalah satu peneliti awal pada tautomerisme keto-enol adalah Emil Erlenmeyer. Aturan Erlenmeyer, yang ia kembangkan tahun 1880, menyatakan bahwa semua alkohol yang terdapat gugus hidroksil melekat langsung pada atom karbon yang terikat rangkap dapat diubah menjadi aldehida atau keton.[10] Konversi ini terjadi karena bentuk keto secara umum lebih stabil daripada tautomer enolnya. Oleh karena itu bentuk keto disukai pada kesetimbangan karena merupakan bentuk energi yang lebih rendah.
Stereokimia ketonisasi
suntingJika R1 dan R2 (lihat persamaan di atas) adalah substituen yang berbeda, terdapat pusat stereo baru yang terbentuk pada posisi alfa ketika enol berubah ke bentuk keto-nya.[11] Tergantung pada sifat dari ketiga gugus R, produk yang dihasilkan dalam situasi ini adalah diastereomer atau enansiomer.[12]
Lihat pula
sunting- Diol geminal, bentuk lain dari keton dan aldehida dalam larutan air
- Regioselektivitas
Referensi
sunting- ^ Taylor, Peter J.; van der Zwan, G.; Antonov, L. (2013). "Tautomerism: Introduction, History, and Recent Developments in Experimental and Theoretical Methods". Dalam Antonov, L. Tautomerism (Methods and Theories). Wiley Blackwell (John Wiley & Sons) (dalam bahasa Inggris). hlm. 1–24. doi:10.1002/9783527658824.
- ^ Lapworth, A. dan Hann, A. (1902). "The mutarotation of camphorquinonehydrazone and mechanism of simple desmotropic change". J. Chem. Soc. (dalam bahasa Inggris). 81: 1508–1519. doi:10.1039/CT9028101508.
- ^ Wirz, J. (2010). "Kinetic studies of Keto–Enol and other tautomeric equilibria by flash photolysis". Adv. Phys. Org. Chem. (dalam bahasa Inggris). 44: 325–356. doi:10.1016/S0065-3160(08)44006-6.
- ^ Anna K. Cederstav dan Bruce M. Novak (1994). "Investigations into the Chemistry of Thermodynamically Unstable Species. The Direct Polymerization of Vinyl Alcohol, the Enolic Tautomer of Acetaldehyde". Journal of the American Chemical Society (dalam bahasa Inggris). 116: 4073–74. doi:10.1021/ja00088a051.
- ^ Dawson, H. dan Wheatley, R. (1910). "The reactivity of ketones towards iodine and the relative rates of tautomeric change". J. Chem. Soc. (dalam bahasa Inggris). 97: 2048–2054. doi:10.1039/CT9109702048.
- ^ Norlander, J.E.; Jindal, S.; Kitko, D. (1969). "Resistance of adamantanone to homoenolization". Journal of the Chemical Society, Chemical Communications (dalam bahasa Inggris): 1136–1137. doi:10.1039/C29690001136.
- ^ Stothers, J.B.; Tan, C.T. (1974). "Adamantanone: stereochemistry of its homoenolization as shown by 2H nuclear magnetic resonance". Journal of the Chemical Society, Chemical Communications (dalam bahasa Inggris) (18): 378–379. doi:10.1039/C39740000738.
- ^ Staib, A., Borgis, D., dan Hynes, J. (1995). "Proton transfer in hydrogenbonded acid–base complexes in polar solvents". J. Chem. Phys. (dalam bahasa Inggris). 102 (6): 2487–2505. Bibcode:1995JChPh.102.2487S. doi:10.1063/1.468678.
- ^ Borgis, D., Lee, S., dan Hynes, J. (1982). "A dynamical theory of nonadiabatic proton and hydrogen atom transfer reaction rates in solution". Chem. Phys. Lett. (dalam bahasa Inggris). 162 (1): 19–26. Bibcode:1989CPL...162...19B. doi:10.1016/0009-2614(89)85059-6.
- ^ Erlenmeyer, E. (1880). "Ueber Phenylbrommilchsäure". Ber. Dtsch. Chem. Ges. (dalam bahasa Jerman). 13: 305–310.
- ^ Keeffe, J., Kresge, A., dan Schepp, N. (1990). "Keto–enol equilibrium constants of simple monofunctional aldehydes and ketones in aqueous solution". J. Am. Chem. Soc. (dalam bahasa Inggris). 112 (12): 4862–4868. doi:10.1021/ja00168a035.
- ^ Capponi, M., Gut, I., Hellrung, P., Perry, G., dan Wirz, J. (1999). "Ketonization equilibria of phenol in aqueous solution". Can. J. Phys. (dalam bahasa Inggris). 77 (5-6): 605–613. doi:10.1139/v99-048.