Polaritas (kimia)
Dalam kimia, polaritas (atau kekutuban) adalah pemisahan muatan listrik yang mengarah pada molekul atau gugus kimia yang memiliki momen listrik dipol atau multipol.[1]
Molekul polar harus mengandung ikatan kimia polar karena perbedaan elektronegativitas antara atom yang berikatan. Molekul polar dengan dua atau lebih ikatan kutub harus memiliki geometri asimetris sehingga momen ikatan tidak saling meniadakan.[2]
Molekul polar berinteraksi melalui gaya antarmolekul dipol-dipol dan ikatan hidrogen. Polaritas mendasari sejumlah sifat fisik termasuk tegangan permukaan, kelarutan,[3] serta titik leleh dan titik didih.
Polaritas ikatan
suntingTidak semua atom menarik elektron dengan kekuatan yang sama. Jumlah "tarikan" atom yang diberikan pada elektron disebut elektronegativitas. Atom dengan elektronegativitas tinggi – seperti fluor, oksigen dan nitrogen – mengerahkan daya tarik elektron lebih besar daripada atom dengan elektronegativitas rendah. Dalam sebuah ikatan, ini menyebabkan pembagian elektron yang tidak setara antara atom, karena elektron akan tertarik mendekati atom dengan elektronegativitas yang lebih tinggi.[1]
Karena elektron memiliki muatan negatif, pembagian elektron yang tidak setara dalam ikatan mengarah pada pembentukan dipol listrik: pemisahan muatan listrik positif dan negatif. Karena jumlah muatan yang dipisahkan dalam dipol tersebut biasanya lebih kecil dari muatan elementer, maka disebut muatan parsial, dilambangkan sebagai δ+ (delta plus) dan δ− (delta minus). Simbol tersebut diperkenalkan oleh Christopher Kelk Ingold dan Edith Hilda Ingold pada tahun 1926.[4][5] Momen dipol ikatan dihitung dengan mengalikan jumlah muatan yang dipisahkan serta jarak antar muatan.
Dipol ini dalam molekul dapat berinteraksi dengan dipol pada molekul lain, menciptakan gaya antarmolekul dipol-dipol.
Klasifikasi
suntingIkatan dapat dikategorikan secara ekstrem[6] – sangat nonpolar atau sangat polar. Ikatan yang benar-benar nonpolar terjadi ketika elektronegativitas identik dan karenanya memiliki perbedaan nol. Ikatan polar sepenuhnya lebih tepat disebut ikatan ionik, dan terjadi ketika perbedaan antara elektronegativitas cukup besar sehingga satu atom benar-benar mengambil elektron dari yang lain. Istilah "polar" dan "nonpolar" biasanya diterapkan pada ikatan kovalen, yaitu ikatan dimana polaritasnya tidak lengkap. Untuk menentukan polaritas ikatan kovalen dengan menggunakan alat numerik, perbedaan antara elektronegativitas atom digunakan.
Polaritas ikatan biasanya dibagi menjadi tiga kelompok berdasarkan perbedaan elektronegativitas antara kedua atom yang berikatan. Menurut skala Pauling:
- Ikatan nonpolar umumnya terjadi ketika perbedaan elektronegativitas antara kedua atom kurang dari 0.5
- Ikatan polar umumnya terjadi ketika perbedaan elektronegativitas antara kedua atom kira-kira antara 0.5 dan 2.0
- Ikatan ionik umumnya terjadi ketika perbedaan elektronegativitas antara dua atom lebih besar dari 2.0
Pauling mendasarkan skema klasifikasi ini pada karakter ionik parsial dari sebuah ikatan, yang merupakan fungsi perkiraan dari perbedaan elektronegativitas antara kedua atom yang berikatan. Ia memperkirakan bahwa selisih 1.7 sesuai dengan karakter ion 50%, sehingga perbedaan yang lebih besar sesuai dengan ikatan yang sebagian besar bersifat ionik.[7]
Polaritas molekul
suntingSementara molekul dapat digambarkan sebagai "kovalen polar", "kovalen nonpolar", atau "ionik", hal ini sering merupakan istilah relatif, dengan satu molekul hanya menjadi lebih polar atau lebih nonpolar daripada yang lain. Namun, sifat berikut adalah ciri molekul tersebut.
Sebuah molekul terdiri dari satu atau lebih ikatan kimia antara orbital molekul dari berbagai atom. Molekul dapat berupa kutub baik sebagai hasil ikatan polar karena perbedaan elektronegativitas seperti yang dijelaskan di atas, atau sebagai akibat dari pengaturan asimetris ikatan kovalen nonpolar dan pasangan elektron yang tidak terikat yang dikenal sebagai orbital molekul.
Molekul polar
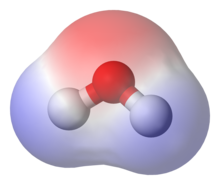
suntingMolekul polar memiliki dipol bersih sebagai akibat dari muatan yang berlawanan (yaitu memiliki muatan positif parsial dan parsial negatif) dari ikatan polar yang disusun secara asimetris. Air (H2O) adalah contoh molekul polar karena memiliki muatan positif sedikit di satu sisi dan sedikit muatan negatif di sisi lain.[8] Dipol tersebut tidak saling meniadakan sehingga menghasilkan dipol bersih. Karena sifat kutub molekul air itu sendiri, molekul polar pada umumnya dapat larut dalam air. Contoh lainnya termasuk gula (seperti sukrosa), yang memiliki banyak gugus oksigen-hidrogen (−OH) polar dan secara keseluruhan sangat polar.
Jika momen dipol ikatan molekul tidak saling meniadakan, molekulnya bersifat polar. Misalnya, molekul air (H2O) mengandung dua ikatan O−H polar dalam suatu geometri tekuk (nonlinear). Momen dipol ikatan tidak meniadakan, sehingga molekul tersebut membentuk dipol dengan kutub negatif pada oksigen dan kutub positif di antara dua atom hidrogen. Pada gambar setiap ikatan bergabung dengan atom O pusat dengan muatan negatif (merah) ke atom H dengan muatan positif (biru).
Ketika membandingkan molekul kutub dan nonpolar dengan massa molar serupa, molekul polar pada umumnya memiliki titik didih lebih tinggi, karena interaksi dipol-dipol antara molekul polar menghasilkan daya tarik antarmolekul yang lebih kuat. Salah satu bentuk interaksi polar yang umum adalah ikatan hidrogen, yang juga dikenal sebagai ikatan-H. Misalnya, air membentuk ikatan H dan memiliki massa molar M = 18 dan titik didih +100 °C, dibandingkan dengan nonpolar metana dengan M = 16 dan titik didih –161 °C.
Molekul nonpolar
suntingSuatu molekul mungkin nonpolar baik bila terdapat pembagian elektron yang sama antara dua atom dari molekul diatomik atau akibat susunan ikatan kutub simetris dalam molekul yang lebih kompleks. Sebagai contoh, boron trifluorida (BF3) memiliki susunan trigonal planar dari tiga ikatan polar pada 120°. Hal ini menghasilkan keseluruhan dipol dalam molekul.
Contoh senyawa nonpolar rumah tangga meliputi lemak, minyak, dan bensin. Oleh karena itu, kebanyakan molekul nonpolar tidak larut dalam air (hidrofobik) pada suhu kamar. Banyak pelarut organik nonpolar, seperti terpentin, yang mampu melarutkan zat polar.
Dalam molekul metana (CH4) empat ikatan C−H disusun secara tetrahedral di sekitar atom karbon. Setiap ikatan memiliki polaritas (meski tidak terlalu kuat). Namun, ikatannya disusun secara simetris sehingga tidak ada keseluruhan dipol dalam molekul. Molekul diatomik oksigen (O2) tidak memiliki polaritas dalam ikatan kovalen karena elektronegativitas yang sama, maka tidak ada polaritas dalam molekul.
Molekul amfifilik
suntingMolekul besar yang memiliki satu ujung dengan gugus polar terlampir dan ujung lainnya dengan kelompok nonpolar digambarkan sebagai molekul amfifil atau amfifilik. Mereka merupakan surfaktan yang baik dan dapat membantu pembentukan emulsi stabil, atau campuran, air dan lemak. Surfaktan mengurangi tegangan antar muka antara minyak dan air dengan mengadsorpsi antarmuka cair-cair.
-
Molekul amfifilik ini memiliki beberapa gugus polar (hidrofilik, suka-air) di sisi kanan dan rantai nonpolar panjang (lipofilik, suka-lemak) di sisi kiri. Hal ini memberikan sifat surfaktan
-
Suatu misel – ujung lipofilik dari molekul surfaktan larut dalam minyak, sementara hidrofilik yang dibebankan berakhir tetap berada di luar dalam fase air, melindungi sisa mikrofil hidrofobik. Dengan cara ini, tetesan minyak kecil menjadi larut dalam air.
-
Fosfolipid adalah surfaktan alami yang efektif yang memiliki fungsi biologis penting
-
Penampang melintang struktur yang bisa dibentuk oleh fosfolipid. Mereka bisa membentuk misel dan sangat vital dalam pembentukan membran sel
Lihat pula
suntingReferensi
sunting- ^ a b Chang, Raymond (2005). Kimia Dasar: Konsep-Konsep Inti Edisi Ketiga Jilid 1 (edisi ke-3rd). Jakarta: Erlangga. ISBN 979-781-039-9.
- ^ Huggins, M. L. (1937). "The Polarity of Chemical Bonds". J. Chem. Phys. 5: 527. doi:10.1063/1.1750070.
- ^ Nordstrom, B. H. (1984). "The Effect of Polarity on Solubility". J. Chem. Educ. 61 (11): 1009. doi:10.1021/ed061p1009.1.
- ^ Jensen, William B. (2009). "The Origin of the "Delta" Symbol for Fractional Charges". J. Chem. Educ. 86: 545. doi:10.1021/ed086p545.
- ^ Ingold, C. K.; Ingold, E. H. (1926). "The Nature of the Alternating Effect in Carbon Chains. Part V. A Discussion of Aromatic Substitution with Special Reference to Respective Roles of Polar and Nonpolar Dissociation; and a Further Study of the Relative Directive Efficiencies of Oxygen and Nitrogen". J. Chem. Soc.: 1310–1328.
- ^ Pauling, L. (1932). "The Nature of the Chemical Bond. III. The Transition from One Extreme Bond Type to Another". J. Am. Chem. Soc. 54 (3): 988–1003. doi:10.1021/ja01342a022.
- ^ Pauling, L. (1960). The Nature of the Chemical Bond (edisi ke-3rd). Oxford University Press. hlm. 98–100.
- ^ Pople, J. A. (1953). "The Electronic Structure and Polarity of the Water Molecule". J. Chem. Phys. 21 (12): 2234. doi:10.1063/1.1698834.