Plumbana
Plumbana adalah sebuah senyawa kimia anorganik dengan rumus kimia PbH4. It is a colorless gas. Senyawa ini merupakan sebuah hidrida logam dan hidrida golongan 14 yang terdiri dari timbal dan hidrogen.[1] Plumbana tidak dikarakterisasi atau dikenal dengan baik, dan tidak stabil secara termodinamika sehubungan dengan hilangnya atom hidrogen.[2] Beberapa turunan dari plumbana meliputi timbal tetrafluorida, PbF4, dan tetraetiltimbal, (CH3CH2)4Pb.
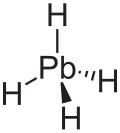
| |
 Timbal, Pb Hidrogen, H | |
| Nama | |
|---|---|
| Nama IUPAC
Plumbana
| |
| Nama lain
timbal tetrahidrida, timbal(IV) hidrida, tetrahidridotimbal, hidrogen plumbida
| |
| Penanda | |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| ChEBI | |
| ChemSpider | |
| Nomor EC | |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| PbH4 | |
| Massa molar | 211,23 g/mol |
| Penampilan | Gas nirwarna |
| Titik didih | −13 °C (9 °F; 260 K) |
| Struktur | |
| Tetrahedral di atom Pb | |
| Senyawa terkait | |
Related Senyawa tetrahidrida
|
|
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Sejarah
suntingHingga saat ini, apakah plumbana pernah benar-benar disintesis masihlah belum pasti,[3] meski laporan pertama berasal dari tahun 1920-an[4] dan pada tahun 1963, Saalfeld dan Svec melaporkan pengamatan PbH+4 melalui spektrometri massa.[5] Plumbana telah berulang kali menjadi subjek studi perhitungan relativistik Dirac–Hartree–Fock, yang menyelidiki kestabilan, geometri, dan energi relatif dari hidrida dengan rumus MH4 atau MH2.[2][6][7]
Sifat
suntingPlumbana adalah gas tak berwarna yang tidak stabil dan merupakan hidrida golongan 14 terberat;[8] serta memiliki struktur tetrahedral (Td) dengan jarak kesetimbangan antara timbal dan hidrogen sebesar 1,73 Å.[9] Menurut beratnya, plumbana terdiri dari 1,91% hidrogen dan 98,09% timbal. Dalam plumbana, keadaan oksidasi formal dari hidrogen dan timbal masing-masing adalah +1 dan -4, karena keelektronegatifan timbal(IV) lebih tinggi daripada hidrogen. Stabilitas hidrida dengan rumus MH4 (M = C–Pb) akan menurun seiring dengan bertambahnya nomor atom M.
Preparasi
suntingStudi awal PbH4 mengungkapkan bahwa molekul ini tidak stabil dibandingkan dengan kongenernya yang lebih ringan, silana, germana, dan stanana.[10] Plumbana tidak dapat dibuat melalui metode yang digunakan untuk mensintesis GeH4 atau SnH4.
Pada tahun 1999, plumbana disintesis dari timbal(II) nitrat, Pb(NO3)2, dan natrium borohidrida, NaBH4.[11] Mekanisme non-nascent untuk sintesis plumbana dilaporkan pada tahun 2005.[12]
Pada tahun 2003, Wang dan Andrews dengan hati-hati mempelajari preparasi PbH4 melalui ablasi laser dan juga mengidentifikasi pita inframerahnya.[13]
Kongener
suntingKongener dari plumbana meliputi:
Referensi
sunting- ^ Porritt, C. J. (1975). Chem. Ind-London. 9: 398. Tidak memiliki atau tanpa
|title=(bantuan) - ^ a b Hein, Thomas A.; Thiel, Walter; Lee, Timothy J. (1993). "Ab initio study of the stability and vibrational spectra of plumbane, methylplumbane, and homologous compounds". The Journal of Physical Chemistry. 97 (17): 4381–4385. doi:10.1021/j100119a021. hdl:11858/00-001M-0000-0028-1862-2 .
- ^ Cotton, F. A.; Wilkinson, G.; Murillo, C. A.; Bochman, M. Advanced Inorganic Chemistry. Wiley: New York, 1999
- ^ Paneth, Fritz; Nörring, Otto (1920). "Über Bleiwasserstoff". Berichte der Deutschen Chemischen Gesellschaft (A and B Series). 53 (9): 1693–1710. doi:10.1002/cber.19200530915.
- ^ Saalfeld, Fred E.; Svec, Harry J. (1963). "The Mass Spectra of Volatile Hydrides. I. The Monoelemental Hydrides of the Group IVB and VB Elements". Inorganic Chemistry. 2: 46–50. doi:10.1021/ic50005a014.
- ^ Desclaux, J. P.; Pyykko, P. (1974). "Relativistic and non-relativistic Hartree-Fock one-centre expansion calculations for the series CH4 to PbH4 within the spherical approximation". Chemical Physics Letters. 29 (4): 534–539. Bibcode:1974CPL....29..534D. doi:10.1016/0009-2614(74)85085-2.
- ^ Pyykkö, P.; Desclaux, J. P. (1977). "Dirac–Fock one-centre calculations show (114)H4 to resemble PbH4". Nature. 266 (5600): 336–337. Bibcode:1977Natur.266..336P. doi:10.1038/266336a0.
- ^ CRC Handbook of Chemistry and Physics Online Edition.
- ^ Visser, O.; Visscher, L.; Aerts, P. J. C.; Nieuwpoort, W. C. (1992). "Relativistic all-electron molecular Hartree-Fock-Dirac-(Breit) calculations on CH4, SiH4, GeH4, SnH4, PbH4". Theoretica Chimica Acta. 81 (6): 405–416. doi:10.1007/BF01134864.
- ^ Malli, Gulzari L.; Siegert, Martin; Turner, David P. (2004). "Relativistic and electron correlation effects for molecules of heavy elements: Ab initio fully relativistic coupled-cluster calculations for PbH4". International Journal of Quantum Chemistry. 99 (6): 940–949. doi:10.1002/qua.20142.
- ^ Krivtsun, V. M.; Kuritsyn, Y. A.; Snegirev, E. P. (1999). "Observation of IR absorption spectra of the unstable PbH4 molecule" (PDF). Opt. Spectrosc. 86 (5): 686–691. Bibcode:1999OptSp..86..686K. Diarsipkan dari versi asli (PDF) tanggal 4 Maret 2016. Diakses tanggal 2012-12-31.
- ^ Zou, Y; Jin, FX; Chen, ZJ; Qiu, DR; Yang, PY (2005). "Non-nascent hydrogen mechanism of plumbane generation". Guang Pu Xue Yu Guang Pu Fen Xi = Guang Pu. 25 (10): 1720–3. PMID 16395924.
- ^ Wang, Xuefeng; Andrews, Lester (2003). "Infrared Spectra of Group 14 Hydrides in Solid Hydrogen: Experimental Observation of PbH4, Pb2H2, and Pb2H4". Journal of the American Chemical Society. 125 (21): 6581–6587. doi:10.1021/ja029862l. PMID 12785799.