Magnesium hidrida
Magnesium hidrida adalah senyawa kimia dengan rumus MgH2, sehingga senyawa ini merupakan hidrida alkali tanah. Senyawa ini telah diteliti untuk mencari kemungkinan apakah senyawa ini dapat dimanfaatkan untuk menyimpan hidrogen.[2]
| |
| |
| Nama | |
|---|---|
| Nama IUPAC
Magnesium hidrida
| |
| Penanda | |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| ChEBI | |
| ChemSpider | |
| Nomor EC | |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
| |
| |
| Sifat | |
| MgH2 | |
| Massa molar | 26.3209 g/mol |
| Penampilan | kristal putih |
| Densitas | 1.45 g/cm3 |
| Titik lebur | 285 °C (545 °F; 558 K) berdekomposisi |
| berdekomposisi | |
| Kelarutan | tidak dapat larut dalam eter |
| Struktur | |
| tetragonal | |
| Termokimia | |
| Kapasitas kalor (C) | 35.4 J/mol K |
| Entropi molar standar (S |
31.1 J/mol K |
| Entalpi pembentukan standar (ΔfH |
-75.2 kJ/mol |
| Energi bebas Gibbs (ΔfG) | -35.9 kJ/mol |
| Bahaya | |
| Bahaya utama | piroforik[1] |
| Senyawa terkait | |
Kation lainnya
|
Berilium hidrida Kalsium hidrida Stronsium hidrida Barium hidrida |
| Magnesium monohidrida Mg4H6 | |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Pembuatan
suntingPada tahun 1951, pembuatan unsur ini pertama kali dilaporkan dengan melakukan hidrogenasi terhadap logam Mg dengan tekanan dan suhu yang tinggi (200 atmosfer, 500 °C) dengan katalis MgI2:[3]
- Mg + H2 → MgH2
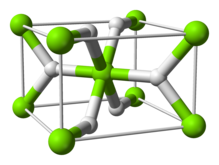
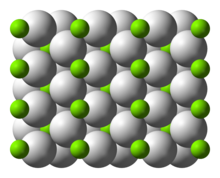
Struktur
suntingPada suhu ruangan, senyawa ini berbentuk α-MgH2 dengan struktur yang mirip dengan TiO2.[4]
Reaksi
suntingMgH2 dapat dengan mudah bereaksi dengan air untuk menghasilkan gas hidrogen:
- MgH2 + 2 H2O → 2 H2 + Mg(OH)2
Pada suhu 287 °C, senyawa ini berdekomposisi dan membentuk H2 dengan tekanan 1 bar.[5] Tingginya suhu yang diperlukan dianggap sebagai keterbatasan dalam upaya untuk menjadikan MgH2 sebagai senyawa untuk menyimpan hidrogen:[6]
- MgH2 → Mg + H2
Referensi
sunting- ^ Synthesis of magnesium hydride by the reaction of phenylsilane and dibutylmagnesium , Michalczyk M.J., Organometallics; (1992); 11(6); 2307-2309. DOI:10.1021/om00042a055
- ^ Catalytic Synthesis of Organolithium and Organomagnesium Compounds and of Lithium and Magnesium Hydrides - Applications in Organic Synthesis and Hydrogen Storage, Bogdanovic B., Angewandte Chemie International Edition in English, 24, 4, 262–73, DOI:10.1002/anie.198502621
- ^ Egon Wiberg, Heinz Goeltzer, Richard Bauer (1951). "Synthese von Magnesiumhydrid aus den Elementen (Synthesis of Magnesium Hydride from the Elements)" (PDF). Zeitschrift für Naturforschung B. 6b: 394.
- ^ Neutron diffraction study of magnesium deuteride, Zachariasen W.H., Holley C.E, Stamper J.F. Jnr, Acta Crystallogr. (1963) 16, 352-353, DOI:10.1107/S0365110X63000967
- ^ McAuliffe, T. R. (1980). Hydrogen and Energy (edisi ke-illustrated). Springer. hlm. 65. ISBN 978-1-349-02635-7. Extract of page 65
- ^ Hydrogen-storage materials for mobile applications, L. Schlapbach and A. Züttel, Nature 414, 353 (2001).DOI:10.1038/35104634 (PDF) https://web.archive.org/web/20050115181834/http://www.iea.org/textbase/work/2003/linking/Schlapbach%20Paper.PDF. Diarsipkan dari versi asli (PDF) tanggal January 15, 2005. Diakses tanggal August 9, 2008. Tidak memiliki atau tanpa
|title=(bantuan)