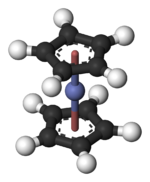
Kobaltosena
Kobaltosena, dikenal pula sebagai bis(siklopentadienil)kobalt(II) atau "bis Cp kobalt", adalah suatu senyawa organokobalt dengan rumus kimia Co(C5H5)2. Senyawa ini adalah padatan berwarna ungu gelap yang menyublim dengan mudah sedikit di atas suhu kamar. Kobaltosena ditemukan tak lama setelah ferosena, metalosena pertama. Karena mudahnya bereaksi dengan oksigen, senyawa tersebut harus ditangani dan disimpan menggunakan teknik bebas udara.
| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC
Kobaltosena
Bis(η5-siklopentadienil)kobalt | |||
| Nama lain
Cp2Co
| |||
| Penanda | |||
Model 3D (JSmol)
|
|||
| 3DMet | {{{3DMet}}} | ||
| ChEBI | |||
| ChemSpider | |||
| Nomor EC | |||
PubChem CID
|
|||
| Nomor RTECS | {{{value}}} | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Sifat | |||
| [Co(η5-C5H5)2] | |||
| Massa molar | 189.12 g/mol | ||
| Penampilan | Padatan ungu gelap | ||
| Titik lebur | 171-173 | ||
| tak larut | |||
| Struktur | |||
| sandwich | |||
| nol | |||
| Termokimia | |||
| Entropi molar standar (S |
236 J K−1 mol−1 | ||
| Entalpi pembentukan standar (ΔfH |
+237 kJ/mol (tak tentu) | ||
| Entalpi pembakaran standar ΔcH |
−5839 kJ/mol | ||
| Bahaya | |||
Klasifikasi UE (DSD) (usang)
|
|||
| Frasa-R | R10, R36/37/38 | ||
| Frasa-S | S9, S16, S26, S33, S37/39 | ||
| Senyawa terkait | |||
Related Metalosena
|
Ferosena Nikelosena Rodosena | ||
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |||
| Referensi | |||
Sintesis
suntingKobaltosena disiapkan oleh reaksi antara natrium siklopentadienida (NaC5H5) dengan kobalt(II) klorida anhidrat dalam larutan THF. Natrium klorida terbentuk bersama, dan produk organologamnya biasanya dimurnikan dengan penyubliman vakum.[1]
Struktur dan pengikatan
suntingDalam Co(C5H5)2 pusat Co "tertumpuk" di antara dua cincin siklopentadienil (Cp). Panjang ikatan Co–C adalah sekitar 2.1 Å, agak lebih panjang dibanding ikatan Fe–C dalam ferosena.[2]
Co(C5H5)2 termasuk dalam golongan senyawa organologam yang disebut sebagai metalosena atau senyawa sandwich.[3] Kobaltosena memiliki 19 elektron valensi, kelebihan satu dari yang biasanya ditemukan dalam kompleks logam organotransisi, seperti ferosena, yang relatif sangat stabil. (Lihat aturan 18 elektron.) Elektron tambahan ini menempati orbital yang anti ikatan terhadap ikatan Co–C. Akibatnya, jarak Co–C agak lebih panjang dibanding ikatan Fe–C dalam ferosena. Banyak reaksi kimia Co(C5H5)2 dicirikan oleh kecenderungannya untuk kehilangan elektron "ekstra" ini, menghasilkan kation 18-elektron yang dikenal sebagai kobaltosenium:
Kerabat dekat kobaltosena, rodosena tidak terdapat sebagai monomer, tetapi secara spontan terdimerisasi oleh pembentukan suatu ikatan C–C antara cincin Cp.
Reaksi
suntingSifat redoks
suntingCo(C5H5)2 adalah agen pereduksi satu-elektron umum di laboratorium.[4] Bahkan, reversibilitas dari pasangan redoks Co(C5H5)2 begitu berperilaku baik sehingga Co(C5H5)2 dapat digunakan dalam voltametri siklik sebagai standar internal.[5] Senyawa analog terpermetilasinya dekametilkobaltosena (Co(C5Me5)2) adalah zat pereduksi yang sangat kuat, karena sumbangan induktif kerapatan elektron dari 10 gugus metil, mendorong kobalt untuk melepaskan elektron "ekstra"nya bahkan lebih. Kedua senyawa ini adalah contoh langka reduktor yang larut dalam pelarut organik non-polar. Berikut adalah potensial reduksi dari senyawa ini, menggunakan pasangan ferosena-ferosenium sebagai referensi:[6]
| Setengah reaksi | E0 (V) |
|---|---|
| Fe(C5H5)+2 + e− ⇌ Fe(C5H5)2 | 0 (per definisi) |
| Fe(C5Me5)+2 + e− ⇌ Fe(C5Me5)2 | −0.59 |
| Co(C5H5)+2 + e− ⇌ Co(C5H5)2 | −1.33 |
| Co(C5Me5)+2 e− ⇌ Co(C5Me5)2 | −1.94 |
Data menunjukkan bahwa senyawa dekametil berada sekitar 600 mV lebih mereduksi daripada metalosena induknya. Efek substituen ini, bagaimanapun, dibayangi oleh pengaruh logam: perubahan dari Fe ke Co menjadikan reduksi lebih disukai dengan lebih dari 1.3 volt.
Karbonilasi
suntingPerlakuan Co(C5H5)2 dengan karbon monoksida menghasilkan turunan kobalt(I) Co(C5H5)(CO)2, seiring dengan hilangnya satu ligan Cp.[1][7]
Lihat pula
suntingReferensi
sunting- ^ a b King, R. B. (1965). Organometallic Syntheses (dalam bahasa Inggris). 1. New York, NY: Academic Press.
- ^ Antipin, M. Yu.; Boese, R.; Augart, N.; Schmid, G. (1993). "Redetermination of the cobaltocene crystal structure at 100 K and 297 K: Comparison with ferrocene and nickelocene". Struct. Chem. (dalam bahasa Inggris). 4 (2): 91–101. doi:10.1007/BF00677370.
- ^ Elschenbroich, C.; Salzer, A. (1992). Organometallics: A Concise Introduction (dalam bahasa Inggris) (edisi ke-2nd). Weinheim: Wiley-VCH. ISBN 3-527-28165-7.
- ^ Connelly, N. G.; Geiger, W. E. (1996). "Chemical Redox Agents for Organometallic Chemistry". Chem. Rev. (dalam bahasa Inggris). 96 (2): 877–910. doi:10.1021/cr940053x. PMID 11848774.
- ^ Rogers, E. I.; Silvester, D. S.; Poole, D. L.; Aldous, L.; Hardacre, C.; Compton, R. G. (2008). "Voltammetric Characterization of the Ferrocene|Ferrocenium and Cobaltocenium|Cobaltocene Redox Couples in RTILs". J. Phys. Chem. C (dalam bahasa Inggris). hlm. 2729–2735. doi:10.1021/jp710134e.
- ^ Lewandowski, A.; Waligora, L.; Galinski, M. (2013). "Electrochemical Behavior of Cobaltocene in Ionic Liquids". J. Solution Chem. (dalam bahasa Inggris). 42 (2): 251–262. doi:10.1007/s10953-013-9957-1.
- ^ Omae, Iwao (2007). "Three Characteristic Reactions of Organocobalt Compounds in Organic Synthesis". Applied Organometallic Chemistry (dalam bahasa Inggris). hlm. 318–344. doi:10.1002/aoc.1213.
Pranala luar
sunting- (Inggris) IARC Monograph "Cobalt and Cobalt Compounds"
- (Inggris) National Pollutant Inventory - Cobalt fact sheet Diarsipkan 2006-02-19 di Wayback Machine.
- (Inggris) NIST Standard Reference Database