Kloroasetil klorida
Kloroasetil klorida adalah asil klorida terklorinasi dan merupakan senyawa dwifungsi, sehingga menjadikannya sebagai bahan untuk membangun blok kimia yang berguna.
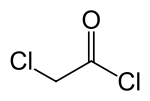
| |

| |
| Nama | |
|---|---|
| Nama IUPAC (preferensi)
Kloroasetil klorida | |
| Nama lain
2-Kloroasetil klorida
Kloroasetil asam klorida Kloroasetil klorida Monokloroasetil klorida | |
| Penanda | |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| ChemSpider | |
| Nomor EC | |
| KEGG | |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| C2H2Cl2O | |
| Massa molar | 112,94 g·mol−1 |
| Penampilan | Cairan tidak berwarna hingga kekuningan |
| Densitas | 1.42 g/mL |
| Titik lebur | −22 °C (−8 °F; 251 K) |
| Titik didih | 106 °C (223 °F; 379 K) |
| Bereaksi | |
| Tekanan uap | 19 mmHg (20 °C)[1] |
| Bahaya | |
| Lembar data keselamatan | Oxford MSDS |
Klasifikasi UE (DSD) (usang)
|
|
| Titik nyala | Tidak mudah terbakar [1] |
| Batas imbas kesehatan AS (NIOSH): | |
PEL (yang diperbolehkan)
|
Tidak ada[1] |
REL (yang direkomendasikan)
|
TWA 0.05 ppm (0.2 mg/m3)[1] |
IDLH (langsung berbahaya)
|
N.D.[1] |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Produksi
suntingSecara industri, senyawa ini diproduksi oleh karbonilasi dari metilen klorida, oksidasi dari vinilidena klorida, atau dengan menambahkan klorin ke ketena.[2] Kloroasetil klorida dapat dibuat dari asam kloroasetat dengan tionil klorida, fosfor pentaklorida, atau fosgen.
Reaksi
suntingKloroasetil klorida bersifat dwifungsi—asil klorida dapat dengan mudah membentuk ester[3] dan amida, sedangkan ujung molekul yang lain dapat membentuk ikatan lainnya, misalnya dengan amina. Berikut ini adalah ilustrasi penggunaan kloroasetil klorida dalam sintesis lidokain:[4]
Aplikasi
suntingFungsi utama kloroasetil klorida adalah sebagai senyawa perantara dalam produksi herbisida di keluarga kloroasetanilida termasuk metolaklor, asetoklor, alaklor dan butaklor. Diperkirakan 100 juta pon kloroasetil klorida dipergunakan setiap tahunnya. Beberapa kloroasetil klorida juga digunakan untuk menghasilkan fenasil klorida, sebuah senyawa kimia yang digunakan menjadi gas air mata.[2] Berikut ini adalah ilustrasi fenasil klorida disintesis dalam asilasi Friedel-Crafts benzena dengan katalis aluminium klorida:[5]
Keamanan
suntingSeperti asil klorida lainnya, reaksi dengan senyawa protik lain seperti amina, alkohol, dan air menghasilkan asam klorida, sehingga menjadi lakrimator (gas air mata).
Tidak ada batas pajanan yang diizinkan yang diatur oleh Occupational Safety and Health Administration. Namun, National Institute for Occupational Safety and Health telah menetapkan batas pajanan yang direkomendasikan adalah 0,05 ppm selama delapan jam pada hari kerja.[6]
Referensi
sunting- ^ a b c d e "NIOSH Pocket Guide to Chemical Hazards #0120". National Institute for Occupational Safety and Health (NIOSH).
- ^ a b Paul R. Worsham (1993). "15. Halogenated Derivatives". Dalam Zoeller, Joseph R.; Agreda, V. H. Acetic acid and its derivatives (Google Books excerpt). New York: M. Dekker. hlm. 288–298. ISBN 0-8247-8792-7.
- ^ Robert H. Baker and Frederick G. Bordwell (1955). "tert-Butyl acetate". Org. Synth.; Coll. Vol. 3.
- ^ T. J. Reilly (1999). "The Preparation of Lidocaine". J. Chem. Educ. 76 (11): 1557. doi:10.1021/ed076p1557. Diarsipkan dari versi asli tanggal 2009-08-07. Diakses tanggal 2020-06-11.
- ^ Nathan Levin and Walter H. Hartung (1955). "ω-Chloroisonitrosoacetophenone". Org. Synth.; Coll. Vol. 3: 191.
- ^ "NIOSH Pocket Guide to Chemical Hazards". Centers for Disease Control and Prevention. 2011.