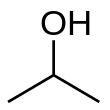
Isopropil alkohol
Isopropil alkohol (nama IUPAC propan-2-ol dan juga dikenal dengan isopropanol) merupakan senyawa kimia dengan rumus molekul C3H8O atau C3H7OH. Senyawa ini merupakan senyawa tak berwarna dan mudah terbakar dengan bau menyengat.
| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC (preferensi)
Propan-2-ol | |||
Nama lain
| |||
| Penanda | |||
Model 3D (JSmol)
|
|||
| 3DMet | {{{3DMet}}} | ||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| Nomor EC | |||
| KEGG | |||
PubChem CID
|
|||
| Nomor RTECS | {{{value}}} | ||
| UNII | |||
| Nomor UN | 1219 | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Sifat | |||
| C3H8O | |||
| Massa molar | 60,10 g·mol−1 | ||
| Penampilan | Cairan tak berwarna | ||
| Densitas | 0.786 g/cm3 (20 °C) | ||
| Titik lebur | −89 °C (−128 °F; 184 K) | ||
| Titik didih | 826 °C (1.519 °F; 1.099 K) | ||
| miscible | |||
| Kelarutan | miscible in benzena, kloroform, etanol, eter, gliserin larut dalam aseton tak larut pada larutan garam | ||
| Keasaman (pKa) | 16.5 | ||
| Indeks bias (nD) | 1.3776 | ||
| Viskositas | 2.86 cP at 15 °C 1.96 cP at 25 °C[1] 1.77 cP at 30 °C For 187K-500K, viscosity (cP) =10^(−0.7009+(8.4150E+02/T)+(-8.6068E-03*T)+(8.2964E-06*(T^2))) (Temp in K)[1] | ||
| 1.66 D (gas) | |||
| Bahaya | |||
| Bahaya utama | Flammable | ||
| Piktogram GHS |  
| ||
| Keterangan bahaya GHS | {{{value}}} | ||
| H225, H319, H336 | |||
| P210, P261, P305+351+338 | |||
| Titik nyala | 11.7 °C (open cup) 13 °C (closed cup) | ||
Threshold limit value (TLV)
|
980 mg/m3 (TWA), 1225 mg/m3 (STEL) | ||
| Dosis atau konsentrasi letal (LD, LC): | |||
LD50 (dosis median)
|
3600 mg/kg (oral, mouse), 12800 mg/kg (dermal, rabbit), LC50 = 53000 mg/m3 (inhalation, mouse) | ||
| Senyawa terkait | |||
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |||
| Referensi | |||
Isopropil alkohol termasuk ke dalam senyawa alkohol yang membuatnya bersifat polar. Di antara golongan alkohol, isopropanol merupakan contoh alkohol sekunder paling sederhana, yakni senyawa dengan atom karbon yang mengikat gugus alkohol dan 2 atom karbon lain. Senyawa ini merupakan isomer struktur dari 1-propanol dan etil metil eter.
Sifat
suntingIsopropil alkohol, sebagai senyawa polar, dapat bercampur dengan senyawa polar lain seperti air, metanol, dan etanol. Senyawa ini, bersama metanol, etanol, 1-propanol, dan tert-butanol merupakan senyawa alkohol sederhana yang bercampur sempurna dengan air.[2]
Isopropil alkohol membentuk azeotrop dengan air sehingga akan mendidih pada temperatur 80,37 °C dengan persen massa 87,7%.[3] Selain itu, isopropanol dapat dibedakan dari alkohol yang lebih sederhana karena senyawa ini tidak bercampur dengan larutan garam sehingga dapat dipisahkan dari larutan berair dengan menambahkan garam seperti natrium klorida atau kalium klorida.[4][5] Proses ini disebut sebagai salting out 'pengawagasan salinitas' yang menyebabkan isopropil alkohol dapat dimurnikan dari air.
Reaksi
suntingIsopropil alkohol dapat diubah menjadi 2-bromopropana dengan reagen fosfor tribromida (PBr3) melalui reaksi subsitusi nukleofilik. Senyawa ini juga dapat mengalami reaksi dehidrasi (eliminasi air) dengan asam sulfat menjadi propena pada keadaan panas.
Isopropil alkohol dapat mengalami oksidasi menjadi aseton dengan menggunakan oksidator seperti kalium dikromat dalam keadaan asam atau dehidrogenasi menggunakan katalis tembaga.
(CH3)2CHOH → (CH3)2CO + H2
Baik aseton maupun isopropil alkohol, keduanya dapat menghasilkan reaksi positif apabila direaksikan dengan iodin dan natrium hidroksida dalam uji iodoform.
Referensi
sunting- ^ a b Yaws, C.L. (1999). Chemical Properties Handbook. McGraw-Hill. ISBN 0-07-073401-1.
- ^ Olsen, Allen L.; Washburn, E. Roger (1935-02). "A Study of Solutions of Isopropyl Alcohol in Benzene, in Water and in Benzene and Water". Journal of the American Chemical Society (dalam bahasa Inggris). 57 (2): 303–305. doi:10.1021/ja01305a021. ISSN 0002-7863.
- ^ Windholz, Martha; Merck & Co, ed. (1983). The Merck index: an encyclopedia of chemicals, drugs, and biologicals (edisi ke-10th ed). Rahway, N.J., U.S.A: Merck. hlm. 749. ISBN 978-0-911910-27-8.
- ^ Gomis, Alejandro; García-Cano, Jorge; Font, Alicia; Gomis, Vicente (2021-02-17). "Operational Limits in Processes with Water, Salt, and Short-Chain Alcohol Mixtures as Aqueous Two-Phase Systems and Problems in Its Simulation". Industrial & Engineering Chemistry Research (dalam bahasa Inggris). 60 (6): 2578–2587. doi:10.1021/acs.iecr.0c05891. ISSN 0888-5885.
- ^ Sinegubova, S. I.; Il’in, K. K.; Cherkasov, D. G.; Kurskii, V. F.; Tkachenko, N. V. (2004-12-01). "Salting-out of isopropyl alcohol from aqueous solutions with potassium nitrate". Russian Journal of Applied Chemistry (dalam bahasa Inggris). 77 (12): 1924–1928. doi:10.1007/s11167-005-0194-2. ISSN 1608-3296.
Pranala luar
sunting- The US government's Occupational Safety and Health Administration's guidelines for isopropyl alcohol. Diarsipkan 2011-12-17 di Wayback Machine.
- MSDS for Isopropyl Alcohol Diarsipkan 2011-12-02 di Wayback Machine.
- Lab Manager Article on Working with Isopropyl Alcohol Diarsipkan 2009-01-13 di Wayback Machine.