Sistem imun
Sistem imun, sistem kekebalan, atau sistem pertahanan tubuh adalah sel-sel dan banyak struktur biologis lainnya yang bertanggung jawab atas imunitas, yaitu pertahanan pada organisme untuk melindungi tubuh dari pengaruh biologis luar dengan mengenali dan membunuh patogen. Sementara itu, respons kolektif dan terkoordinasi dari sistem imun tubuh terhadap pengenalan zat asing disebut respons imun. Agar dapat berfungsi dengan baik, sistem ini akan mengidentifikasi berbagai macam pengaruh biologis luar seperti dari infeksi, bakteri, virus sampai parasit, serta menghancurkan zat-zat asing lain dan memusnahkan mereka dari sel dan jaringan organisme yang sehat agar tetap berfungsi secara normal.
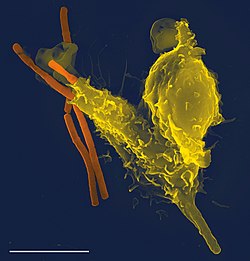
Manusia dan vertebrata berahang lainnya memiliki mekanisme pertahanan yang kompleks, yang dapat dibagi menjadi sistem imun bawaan dan sistem imun adaptif. Sistem imun bawaan merupakan bentuk pertahanan awal yang melibatkan penghalang permukaan, reaksi peradangan, sistem komplemen, dan komponen seluler. Sistem imun adaptif berkembang karena diaktifkan oleh sistem imun bawaan dan memerlukan waktu untuk dapat mengerahkan respons pertahanan yang lebih kuat dan spesifik. Imunitas adaptif (atau dapatan) membentuk memori imunologis setelah respons awal terhadap patogen dan membuat perlindungan yang lebih ditingatkan pada pertemuan dengan patogen yang sama berikutnya. Proses imunitas dapatan ini menjadi dasar dari vaksinasi.
Gangguan pada sistem imun dapat berupa imunodefisiensi, penyakit autoimun, penyakit inflamasi, dan kanker.[1] Imunodefisiensi dapat terjadi ketika sistem imun kurang aktif sehingga dapat menimbulkan infeksi berulang dan dapat mengancam jiwa. Pada manusia, imunodefisiensi dapat disebabkan karena faktor genetik seperti pada penyakit defisiensi imunitas kombinasi serta kondisi dapatan seperti sindrom defisiensi imun dapatan (AIDS) yang disebabkan oleh retrovirus HIV. Sebaliknya, penyakit autoimun menyebabkan sistem imun menjadi hiperaktif menyerang jaringan normal seakan-akan jaringan tersebut merupakan benda asing. Di satu sisi, ilmu pengetahuan pun terus berkembang dan manipulasi dalam kedokteran telah dilakukan. Penggunaan obat imunosupresif telah berhasil menekan sistem imun yang hiperaktif, dan penggunaan imunoterapi telah dilakukan untuk pengobatan kanker.
Patogen dapat berevolusi secara cepat dan mudah beradaptasi agar terhindar dari identifikasi dan penghancuran oleh sistem imun, tetapi mekanisme pertahanan tubuh juga berevolusi untuk mengenali dan menetralkan patogen. Bahkan organisme uniseluler seperti bakteri juga memiliki sistem imun sederhana dalam bentuk enzim yang melindunginya dari infeksi bakteriofag. Mekanisme imun lainnya terbentuk melalui evolusi pada eukariota kuno tetapi masih ada hingga sekarang seperti pada tumbuhan dan invertebrata.
Sejarah imunologi
Imunologi adalah ilmu yang mempelajari struktur dan fungsi sistem imun. Imunologi awalnya berasal dari ilmu mikrobiologi. Imunitas pertama kali diketahui saat terjadi wabah Athena pada 430 SM. Thukidides mencatat bahwa orang yang sembuh dari penyakit sebelumnya dapat bertahan tanpa terkena penyakit lagi.[2] Lambat laun, diciptakan istilah "immunity" yang diturunkan dari istilah Latin "immunitas" untuk menggambarkan resistensi semacam itu. Pada abad ke-10, dokter Iran Al-Razi merupakan orang pertama yang membedakan antara cacar (smallpox) dan campak (measles) dan juga mencatat kemungkinan teori pertama tentang imunitas dapatan (acquired immunity). Pada abad ke-11, dokter dan filsuf Ibnu Sina juga mengusulkan teori lebih lanjut untuk imunitas dapatan.[3]
Pada sekitar 1000 M, bangsa Tiongkok dilaporkan telah mempraktikkan bentuk imunisasi ini dengan menghirup bubuk kering yang berasal dari kulit lesi cacar. Pada awal abad ke-18 muncul minat baru pada imunitas dapatan melalui penggunaan variolasi sebagai tindakan pencegahan, yaitu dengan memasukkan sebagian dari lesi penderita cacar ke dalam tubuh orang yang sehat. Praktik variolasi juga makin umum dilakukan Inggris pada tahun 1720-an karena usaha Mary Wortley Montagu, istri duta besar Inggris untuk Konstantinopel (sekarang Istanbul), yang mengamati efek positifnya dan melakukannya pada anak-anaknya. Pada tahun 1798 Edward Jenner mempublikasikan hasil vaksinasinya yang pertama, menggunakan nanah dari penderita cacar sapi (cowpox) dan disuntikkan ke seorang anak bernama James Phipps.[3]
Pengamatan imunitas dapatan berikutnya diteliti oleh Louis Pasteur pada tahun 1880 tentang vaksinasi dan pembuktian teori kuman penyakit.[4] Teori tersebut menyatakan bahwa penyakit disebabkan oleh mikroorganisme, dan teori ini merupakan perlawanan dari teori penyakit saat itu, seperti teori miasma yang menyatakan penyakit disebabkan oleh uap atau kabut beracun yang diyakini terdiri dari partikel-partikel dari bahan pembusuk dan dapat diidentifikasi dengan baunya yang busuk.[5] Lebih lanjut, Robert Koch membuktikan teori kuman ini pada 1891, untuk itu ia diberikan penghargaan Nobel pada 1905. Ia membuktikan bahwa mikroorganisme merupakan penyebab dari penyakit infeksi.[6] Virus dikonfirmasi sebagai patogen manusia pada 1901 dengan penemuan virus demam kuning oleh Walter Reed.[7]
Imunologi mengalami perkembangan luar biasa pada akhir abad ke-19 pada penelitian imunitas humoral dan imunitas diperantarai sel.[8] Paul Ehrlich mengusulkan teori rantai samping yang menjelaskan spesifisitas interaksi antigen-antibodi. Kontribusinya dalam memahami imunitas humoral diakui dengan penghargaan Nobel pada 1908, yang bersamaan dengan penghargaan untuk pendiri imunologi seluler, Elie Metchnikoff.[9]
Perlindungan berlapis
Sistem imun tubuh melindungi organisme dari infeksi dengan perlindungan berlapis yang semakin dalam semakin tinggi spesifisitasnya (kekhususannya terhadap jenis infeksi). Pelindung fisik mencegah patogen seperti bakteri dan virus memasuki tubuh. Jika patogen melewati pelindung tersebut, sistem imun bawaan menyediakan perlindungan dengan segera dalam hitungan menit hingga jam. Sistem imun bawaan ditemukan pada semua jenis tumbuhan dan hewan.[10] Jika patogen berhasil melewati respons bawaan, vertebrata memiliki lapisan perlindungan berikutnya yaitu sistem imun adaptif yang diaktifkan oleh respons imun bawaan. Di sini, sistem imun mengadaptasi respons tersebut selama infeksi untuk meningkatkan pengenalan patogen tersebut. Respons ini lalu dipertahankan setelah patogen dimusnahkan dalam wujud memori imunologis sehingga pada kemudian hari sistem imun adaptif dapat melawan patogen yang sama dengan lebih cepat dan efektif.[11]
Sistem imun bawaan dan sistem imun adaptif keduanya memiliki komponen seluler dan humoral, dan masing-masing memberikan imunitas diperantarai sel dan imunitas humoral. Imunitas diperantarai sel diperankan oleh sel-sel imun seperti neutrofil, makrofag, sel NK, dan limfosit, sedangkan imunitas humoral diperankan oleh komponen terlarut seperti antibodi dan protein komplemen. Antibodi adalah protein yang merupakan produk dari sel B yang teraktivasi yang berperan dalam menetralkan patogen dan menginisiasi proses imunologi yang lain seperti pengaktifan sistem komplemen, pengaktifan pembunuhan sel NK, sel T sitotoksik, dan sel-sel efektor lainnya.[12]
| Sistem imun bawaan | Sistem imun adaptif |
|---|---|
| Respons tidak spesifik | Respons spesifik patogen dan antigen |
| Paparan menyebabkan respons maksimal segera | Perlambatan waktu antara paparan dan respons maksimal |
| Komponen imunitas diperantarai sel dan imunitas humoral | Komponen imunitas diperantarai sel dan imunitas humoral |
| Tidak ada memori imunologis | Paparan menyebabkan adanya memori imunologis |
| Ditemukan hampir pada semua bentuk kehidupan | Hanya ditemukan pada vertebrata berahang |
Baik imunitas bawaan dan adaptif bergantung pada kemampuan sistem imun untuk membedakan molekul self dan non-self. Dalam imunologi, molekul self adalah komponen tubuh organisme yang dapat dibedakan dari bahan asing oleh sistem imun. Sebaliknya, molekul non-self adalah yang dianggap sebagai molekul asing. Satu kelas dari molekul non-self adalah antigen (kependekan dari bahasa Inggris antibody generator atau "pembangkit antibodi") yaitu bahan-bahan yang mengikat reseptor imun tertentu dan membangkitkan respons imun.[13]
Bayi yang baru lahir mendapat beberapa lapisan perlindungan pasif yang disediakan oleh ibu. Selama kehamilan, jenis antibodi yang disebut IgG yang dikirim dari ibu ke bayi secara langsung melewati plasenta, sehingga bayi memiliki antibodi tinggi bahkan saat lahir, dengan rentang spesifisitas antigen (fragmen kecil patogen) yang sama dengan ibunya.[14] Air susu ibu atau kolostrum juga mengandung antibodi yang dikirim ke sistem pencernaan bayi dan melindungi bayi terhadap infeksi bakteri sampai bayi dapat menyintesis antibodinya sendiri.[15] Hal ini disebut imunitas pasif karena fetus tidak membuat sel memori atau antibodi sendiri. Pada ilmu kedokteran, imunitas pasif protektif juga dapat dikirim dari satu individu ke individu lainnya melalui serum yang kaya antibodi.[16]
Sistem imun bawaan
Mikroorganisme atau racun yang berhasil memasuki organisme akan berhadapan dengan mekanisme sistem imun bawaan. Respons bawaan biasanya dijalankan ketika mikrob teridentifikasi oleh reseptor pengenal pola (pattern recognition receptor, PRR) yang mengenali komponen yang disebut pola molekuler terkait patogen (pathogen-associated molecular pattern, PAMP),[17] atau pola molekuler terkait kerusakan (damage-associated molecular pattern, DAMP).[18] Sistem ini tidak memberikan perlindungan yang bertahan lama terhadap serangan patogen, sehingga diperlukan sistem imun lain yaitu sistem imun adaptif. Sistem imun bawaan merupakan sistem dominan pertahanan tubuh pada kebanyakan organisme.[10]
Penghalang permukaan
Beberapa penghalang melindungi organisme dari infeksi, termasuk penghalang mekanis, kimiawi, dan biologis. Contoh penghalang mekanis yaitu kulit ari tanaman pada daun, eksoskeleton serangga, kulit telur dan membran bagian luar dari telur, serta kulit yang merupakan pertahanan awal terhadap infeksi. Namun, karena organisme tidak dapat sepenuhnya tertutup sempurna dari lingkungan, sistem lainnya diperlukan untuk melindungi tubuh pada bagian seperti paru-paru, usus, dan saluran urogenital. Pada paru-paru, batuk dan bersin secara mekanis mengeluarkan patogen dan iritan lainnya dari saluran pernapasan.[19] Pengeluaran air mata dan urin juga secara mekanis mengeluarkan patogen, sementara ingus dikeluarkan oleh saluran pernapasan dan saluran pencernaan untuk menangkap mikroorganisme.[20]
Penghalang kimiawi juga melindungi tubuh terhadap infeksi. Kulit dan sistem pernapasan mengeluarkan peptida antimikrobial seperti β-defensin.[21] Enzim seperti lisozim dan fosfolipase A2 pada air liur, air mata, dan air susu ibu juga bersifat antibakteri.[22][23] Sekresi vagina berperan sebagai penghalang kimiawi selama menstruasi pertama, membuat lingkungan vagina agak bersifat asam, sementara semen mengandung defensin dan seng untuk membunuh patogen.[24][25] Pada lambung, asam lambung dan protease menyediakan pertahanan kimiawi yang sangat kuat untuk melawan patogen yang tertelan.[26]
Flora komensal dalam saluran pencernaan dan saluran urogenital merupakan penghalang biologi yang bersaing dengan patogen untuk makanan dan tempat. Selain itu, flora komensal kadang mengubah kondisi lingkungan mereka seperti pH atau ketersediaan zat besi.[27] Hal ini menyebabkan adanya hubungan simbiosis antara flora komensal dan sistem imun, hingga mengurangi jumlah patogen dan kemungkinan munculnya penyakit. Namun, karena kebanyakan antibiotik menyasar bakteri dan tidak menyerang fungi, antibiotik oral dapat mengakibatkan "pertumbuhan berlebih" dari fungi dan dapat memicu kondisi seperti kandiasis vagina (infeksi jamur pada vagina).[28] Terdapat bukti kuat bahwa konsumsi flora probiotik, seperti kultur murni lactobacillus (umum ditemukan pada yogurt yang belum dipasteurisasi), membantu mengembalikan keseimbangan komposisi mikrob pada usus anak-anak yang terkena infeksi. Hasil penelitian awal juga menunjukkan hal yang serupa dalam kasus gastroenteritis bakterial, radang usus, infeksi saluran kemih, dan infeksi setelah operasi.[29][30][31]
Peradangan
Peradangan merupakan salah satu dari respons pertama sistem imun terhadap infeksi.[32] Gejala peradangan yaitu kemerahan, bengkak, dan nyeri yang diakibatkan oleh peningkatan aliran darah ke jaringan. Peradangan dihasilkan oleh senyawa-senyawa eikosanoid dan molekul sitokin, yang dilepaskan oleh sel yang terinfeksi. Senyawa-senyawa eikosanoid, termasuk prostaglandin, menginduksi demam dan pelebaran pembuluh darah, dan leukotrien yang menarik sel darah putih (leukosit).[33][34] Sitokin juga terlibat, termasuk interleukin yang bertanggung jawab untuk komunikasi antarsel darah putih; kemokin yang mendorong kemotaksis; dan interferon yang memiliki kemampuan antivirus, seperti menghentikan sintesis protein virus yang sedang menginfeksi sel inang.[35] Faktor pertumbuhan dan faktor sitotoksik juga dapat dilepaskan. Sitokin dan senyawa kimia lainnya mengerahkan sel-sel imun ke tempat infeksi dan menyembuhkan jaringan yang mengalami kerusakan yang diikuti dengan pemusnahan patogen.[36]
Sistem komplemen
Sistem komplemen merupakan kaskade biokimia (rangkaian reaksi berurutan) yang akhirnya menyerang permukaan sel asing. Sistem komplemen terdiri dari lebih dari 20 protein yang berbeda. Sistem ini dinamakan komplemen ("sesuatu yang melengkapi") karena pertama kali kemampuannya dikenali untuk "melengkapi" pembunuhan patogen oleh antibodi. Komplemen merupakan komponen humoral utama dari respons imun bawaan.[37] Banyak spesies memiliki sistem komplemen, termasuk spesies bukan mamalia seperti tumbuhan, ikan, dan beberapa invertebrata.[38]
Pada manusia, respons ini diaktifkan oleh protein komplemen yang terikat ke antibodi yang menempel pada mikrob tersebut atau protein komplemen yang terikat dengan karbohidrat di permukaan mikrob. Sinyal pengenalan ini memicu respons pembunuhan yang cepat.[39] Kecepatan respons ini merupakan hasil dari penguatan yang muncul setelah pengaktifan proteolisis (pemecahan) dari molekul komplemen, yang juga merupakan protease. Setelah protein komplemen terikat pada mikrob, protein-protein ini mengaktifkan aktivitas proteasenya, yang kemudian mengaktifkan protease komplemen lainnya, dan seterusnya. Hasilnya adalah kaskade katalisis yang memperkuat sinyal awal melalui umpan balik positif teratur.[40] Hasil kaskade ini adalah peptida-peptida yang menarik sel-sel imun, meningkatkan permeabilitas pembuluh darah, dan membungkus permukaan patogen (opsonisasi) sehingga menandainya untuk dihancurkan. Protein komplemen yang berkumpul ini juga dapat membunuh sel secara langsung dengan cara merusak membran plasma sel patogen.[37]
Komponen seluler
Leukosit (sel darah putih) bertindak layaknya organisme bersel tunggal yang bebas dan merupakan pertahanan penting dalam sistem imun bawaan. Jenis-jenis leukosit dalam sistem imun bawaan di antaranya fagosit (makrofag, neutrofil, dan sel dendritik), sel limfoid bawaan, sel mast, eosinofil, basofil, dan sel NK. Sel-sel tersebut mengidentifikasi dan menghilangkan patogen dengan cara menyerang patogen yang lebih besar melalui kontak atau dengan cara menelan dan lalu membunuh mikroorganisme.[19] Sel-sel pada imunitas bawaan juga merupakan mediator penting pada pengaktifan sistem imun adaptif.[41]
Makrofag, neutrofil, dan sel dendritik merupakan kelas sel sensor yang mendeteksi dan menginisiasi respons imun dengan menghasilkan mediator inflamasi. Sel-sel ini mengekspresikan sejumlah reseptor terbatas untuk mengenali patogen atau sel yang rusak, bernama PRR. Beberapa PRR merupakan reseptor transmembran (reseptor pada permukaan sel), seperti reseptor jenis Toll (Toll-like receptor, TLR) yang dapat mendeteksi struktur pola molekuler terkait patogen (pathogen-associated molecular pattern, PAMP) yang dihasilkan oleh bakteri ekstraseluler atau bakteri yang ditangkap dan mengalami fagositosis. PRR lainnya merupakan protein sitoplasmik (berada di sitoplasma) misalnya reseptor jenis NOD (NOD-like receptor, NLR) yang dapat mendeteksi serangan bakteri intraseluler.[42]
Fagosit
Fagositosis adalah sifat penting pada imunitas bawaan yang dilakukan oleh sel fagosit, yaitu sel yang menelan patogen atau partikel. Fagosit biasanya berpatroli di seluruh tubuh mencari patogen, tetapi dapat dipanggil ke lokasi spesifik oleh sitokin.[19] Ketika patogen ditelan oleh fagosit, patogen terperangkap di vesikel intraseluler yang disebut fagosom, yang sesudah itu menyatu dengan vesikel lainnya disebut lisosom untuk membentuk fagolisosom. Patogen dibunuh oleh aktivitas enzim pencernaan atau ledakan pernapasan (respiratory burst) yang mengeluarkan molekul radikal bebas ke fagolisosom.[43][44] Secara evolusi, fungsi asal fagositosis adalah untuk memperoleh nutrisi, tetapi peran ini diperluas sehingga fagosit juga berfungsi menelan patogen sebagai mekanisme pertahanan.[45] Fagositosis mungkin mewakili bentuk pertahanan tertua, karena fagosit telah diidentifikasikan ada pada vertebrata dan invertebrata.[46]
Neutrofil dan monosit merupakan fagosit utama yang berkeliling di seluruh tubuh untuk mengejar dan menyerang patogen.[47] Neutrofil ditemukan di aliran darah dan merupakan jenis fagosit yang paling melimpah, normalnya sebanyak 50% sampai 60% jumlah leukosit yang bersirkulasi.[48] Selama radang fase akut, terutama karena infeksi bakteri, neutrofil bermigrasi ke tempat radang dalam sebuah proses yang disebut kemotaksis, dan merupakan sel pertama yang tiba pada saat infeksi.[49]
Makrofag merupakan sel serba guna yang bermukim pada jaringan dan menghasilkan banyak zat-zat kimia termasuk enzim, protein komplemen, dan sitokin. Makrofag juga bertindak sebagai "sel pemakan" yang membersihkan tubuh dari sel mati dan debris (pecahan komponen sel) lainnya, dan sebagai sel penyaji antigen yang mengaktifkan sistem imun adaptif.[50]
Sel dendritik
Sel dendritik adalah fagosit pada jaringan yang berhubungan dengan lingkungan luar; oleh karena itu, sel-sel ini terutama berada di kulit, hidung, paru-paru, lambung, dan usus.[51] Mereka dinamai demikian karena kemiripannya dengan dendrit saraf, keduanya memiliki proyeksi seperti paku, tetapi sel dendritik tidak ada hubungan dengan sistem saraf. Sel dendritik menyediakan hubungan antara sistem imun adaptif dan bawaan, dengan cara menyajikan antigen kepada sel T.[51]
Sel pembunuh alami
Sel pembunuh alami (Inggris: Natural Killer, NK) merupakan komponen sistem imun bawaan yang tidak secara langsung menyerang mikrob penyerang.[52] Sebaliknya, sel-sel NK menghancurkan sel-sel inang yang terinfeksi atau sel yang bertransformasi.[53] Sel-sel demikian dinamakan "missing self" ("kehilangan pengenalan diri") dikarenakan sel memiliki penanda permukaan sel (disebut MHC I) yang sangat rendah. Sel NK dinamai "pembunuh alami" karena gagasan awal bahwa mereka tidak memerlukan pengaktifan untuk membunuh sel-sel yang "missing self." Sel-sel tubuh normal tidak dikenali dan tidak diserang oleh sel-sel NK karena mereka mengekspresikan antigen MHC diri yang utuh. Kompleks antigen diri MHC itu dikenali oleh reseptor imunoglobulin sel pembunuh (KIR) yang menahan aktivitas sel NK.[54]
Sel mast
Sel mast adalah sel penting dari sistem kekebalan dan merupakan bagian dari hematopoietik. Sel mast berasal dari sel progenitor pluripoten dari sumsum tulang, dan matang di bawah pengaruh ligan c-kit dan faktor sel induk dengan adanya faktor pertumbuhan lain yang berbeda yang disediakan oleh lingkungan mikro jaringan. Dalam kondisi normal, sel mast yang matang tidak bersirkulasi dalam aliran darah. Namun, sel mast yang matang bermigrasi ke jaringan dan berdiferensiasi menjadi sel mast di bawah pengaruh faktor sel induk dan berbagai sitokin. Sel mast terdapat di seluruh tubuh dan mereka memainkan peran penting dalam pemeliharaan banyak fungsi fisiologis serta dalam patofisiologi penyakit.[55]
Sel mast terletak di jaringan penghubung dan membran mukosa, berfungsi untuk mengatur respons peradangan.[56] Mereka berkaitan dengan alergi dan anafilaksis.[48] Pada hewan pengerat, sel mast juga berada di rongga peritoneal dan toraks. Sel mast ditemukan di semua jaringan vaskuler kecuali sistem saraf pusat dan retina.[57] Sel mast terletak pada titik pertemuan pejamu dan lingkungan luar tempat masuknya antigen (saluran cerna, kulit, epitel respiratori).[58] Sel mast terletak di daerah di bawah epitel di jaringan ikat yang mengelilingi sel darah, otot polos, mukosa, dan folikel rambut.
Granulosit
Basofil dan eosinofil memiliki kesamaan dengan neutrofil dalam hal adanya banyak granul di sitoplasmanya. Mereka menyekresikan bahan kimia yang ikut serta melindungi tubuh terhadap parasit dan memainkan peran pada reaksi alergi, seperti asma.[59]
Sel limfoid bawaan
Sel limfoid bawaan (Inggris: innate lymphoid cell, ILC) adalah sekelompok sel imun bawaan yang termasuk dalam garis keturunan limfoid, tetapi tidak memiliki reseptor sel B atau reseptor sel T spesifik antigen. ILC juga tidak mengekspresikan penanda sel myeloid atau dendritik.[60] Kelompok sel ini memiliki fungsi fisiologis yang bervariasi; beberapa fungsi dianalogikan dengan sel T pembantu, sementara kelompok ini juga termasuk sel NK sitotoksik. Oleh karena itu, mereka memiliki peran penting dalam kekebalan protektif dan pengaturan homeostasis dan peradangan, sehingga kelainan pada ILC dapat menyebabkan gangguan sistem imun seperti alergi, asma bronkial, dan penyakit autoimun.[61]
Sistem imun adaptif
Sistem imun adaptif berevolusi pada vertebrata awal dan membuat adanya respons imun yang lebih kuat serta terbentuknya memori imunologi, yaitu tiap patogen "diingat" oleh pengenal antigen.[62] Respons imun adaptif bersifat spesifik terhadap antigen tertentu dan membutuhkan pengenalan antigen non-self tertentu selama proses yang disebut presentasi antigen. Spesifisitas antigen memungkinkan produksi respons yang disesuaikan pada patogen tertentu atau sel tertentu yang terinfeksi patogen. Kemampuan tersebut dipelihara di tubuh oleh "sel memori". Sel-sel memori ini akan segera memusnahkan dengan cepat patogen-patogen yang menginfeksi sel kembali di kemudian hari.
Imunitas diperantarai sel
Komponen sel utama pada sistem imun adaptif yaitu jenis leukosit khusus yang disebut limfosit. Limfosit T (sel T) dan limfosit B (sel B) merupakan jenis limfosit utama yang berasal dari sel punca hematopoietik pada sumsum tulang.[42] Sel T terlibat dalam respons imun diperantarai sel, sedangkan sel B terlibat dalam respons imun humoral.[63] Baik sel T dan sel B memiliki reseptor yang mengenali target spesifik. Sel T mengenali target non-self seperti patogen, tetapi hanya jika antigen telah diolah dan disajikan pada molekul kompleks histokompatibilitas utama (bahasa Inggris: major histocompatibility complex, disingkat MHC).[42] Sementara itu, reseptor antigen pada sel B, yang merupakan suatu molekul antibodi pada permukaan, dapat mengenali semua patogen tanpa perlu adanya pengolahan antigen. Tiap garis keturunan sel B memiliki antibodi yang berbeda, sehingga kumpulan reseptor antigen sel B yang lengkap mewakili semua antibodi yang dapat diproduksi oleh tubuh.[42]
Awalnya, subtipe sel T dibagi menjadi dua yaitu sel T sitotoksik (sel T pembunuh) dan sel T pembantu. Namun seiring pesatnya penelitian imunologi pada dekade terakhir, banyak ditemukan jenis lain dari limfosit misalnya sel T gamma delta (sel T γδ). Sel T sitotoksik hanya mengenali antigen yang dirangkaikan pada molekul MHC kelas I, sementara sel T pembantu hanya mengenali antigen yang dirangkaikan pada molekul MHC kelas II. Dua mekanisme presentasi antigen tersebut memunculkan peran berbeda dua tipe sel T. Jenis lain sel T yang termasuk subtipe minor yaitu sel T γδ, yang mengenali antigen yang tidak melekat pada molekul MHC.[64]
Sel T sitotoksik
Sel T sitotoksik (Inggris: cytotoxic T lymphocyte, CTL) atau sel T pembunuh merupakan subkelompok dari sel T yang membunuh sel yang terinfeksi virus (dan patogen lainnya), sel-sel yang rusak, atau sel yang tidak berfungsi dengan baik.[66] Sel T sitotoksik diaktifkan ketika reseptor sel T melekat pada antigen spesifik ini dalam sebuah kompleks dengan reseptor MHC kelas I dari sel lainnya. Pengenalan MHC:antigen ini dibantu oleh koreseptor pada sel T yang disebut CD8. Sel T lalu berkeliling ke seluruh tubuh untuk mencari sel yang menyajikan antigen ini pada molekul MHC kelas I. Ketika sel T yang aktif berikatan dengan sel yang demikian, sel T melepaskan protein sitotoksik (seperti perforin) yang dapat membentuk pori pada membran plasma target, membuat ion, air, dan toksin masuk ke dalamnya. Hal ini menyebabkan sel mengalami apoptosis.[67] Sel T sitotoksik penting untuk mencegah replikasi virus. Pengaktifan sel T membutuhkan sinyal pengaktifan antigen/MHC yang sangat kuat dan sinyal pengaktifan tambahan yang disediakan oleh sel T pembantu.[67]
Sel T pembantu
Sel T pembantu (Inggris: T helper cell, Th) mengatur respons imun bawaan dan respons imun adaptif, serta membantu menentukan jenis respons imun pada patogen khusus.[68][69] Sel tersebut tidak memiliki aktivitas sitotoksik dan tidak membunuh sel yang terinfeksi atau membersihkan patogen secara langsung, tetapi mereka mengontrol respons imun dengan mengarahkan sel lain untuk melakukan tugas tersebut.[70]
Sel T pembantu mengekspresikan reseptor sel T yang mengenali antigen terikat pada molekul MHC kelas II. MHC:antigen juga dikenali oleh protein CD4 yang penting dalam pengaktifan sel T. Sel T pembantu memiliki ikatan yang lebih lemah dengan MHC: antigen daripada sel T sitotoksik, sehingga pengaktifannya memerlukan lebih banyak ikatan (sekitar 200-300), sementara sel T sitotoksik dapat diaktifkan dengan satu ikatan molekul MHC:antigen dengan reseptor. Pengaktifan sel T pembantu juga membutuhkan durasi pengikatan lebih lama dengan sel yang memiliki antigen.[71] Sel T pembantu yang telah aktif selanjutnya menyekresikan sitokin yang memengaruhi aktivitas banyak jenis sel. Sinyal sitokin yang dihasilkan oleh sel T pembantu memperbesar fungsi mikrobisidal dari makrofag dan aktivitas sel T sitotoksik.[19] Selain itu, pengaktifan sel T pembantu menyebabkan peningkatan molekul yang diekspresikan pada permukaan sel T, seperti CD40 (juga dikenal sebagai CD154), yang menyediakan sinyal stimulasi tambahan yang dibutuhkan untuk mengaktifkan sel B menjadi sel plasma.[72]
Sel T gamma delta
Sel T gamma delta (sel T γδ) memiliki reseptor sel T alternatif yang berbeda dengan sel T CD4+ dan CD8+ (αβ), serta memiliki ciri yang mirip dengan sel T pembantu, sel T sitotoksik, dan sel NK, sehingga berada pada perbatasan antara sistem imun adaptif dan sistem imun bawaan.[73] Di satu sisi, sel T γδ merupakan komponen dari sistem imun adaptif karena gen reseptor sel T menjalani penataan ulang dan menghasilan diversitas reseptor serta dapat mengembangkan memori. Di sisi lain, beberapa bagian sel ini merupakan komponen sistem imun bawaan karena reseptor sel T atau reseptor NK yang dimilikinya dapat digunakan sebagai PRR. Contohnya sejumlah besar sel T Vγ9/Vδ2 berespons dalam hitungan jam terhadap molekul umum yang diproduksi oleh mikrob, dan jenis sel T Vδ1+ yang khusus hanya ada di epitelium, merespons terhadap sel epitelial yang rusak.[74]
Imunitas humoral
Pada sistem imun adaptif, peran utama imunitas humoral dijalankan oleh antibodi yang dihasilkan oleh sel B. Sel B mengidentifikasi patogen ketika antibodi yang terikat pada permukaan sel B berikatan dengan antigen asing spesifik.[75] Kompleks antigen:antibodi ini ditelan oleh sel B kemudian antigen dipecah menjadi potongan peptida (proteolisis). Selanjutnya sel B menyajikan peptida antigenik pada permukaan molekul MHC kelas II. Kompleks MHC dan antigen ini menarik sel T pembantu yang memiliki kesesuaian dengan antigen, yang selanjutnya melepaskan sitokin dan mengaktifkan sel B.[76] Sel B yang aktif berikutnya berdiferensiasi menjadi sel plasma yang mengeluarkan jutaan antibodi yang mengenali antigen itu. Antibodi tersebut diedarkan pada plasma darah dan limfatik, mengikat patogen dan menandainya untuk dihancurkan oleh pengaktifan komplemen, atau untuk penghancuran oleh fagosit. Antibodi juga dapat menetralkan toksin bakteri atau dengan mengganggu reseptor yang digunakan virus dan bakteri untuk menginfeksi sel.[77]
Regulasi fisiologis
Sistem imun terlibat dalam banyak aspek regulasi fisiologis dalam tubuh. Sistem imun berinteraksi secara intensif dengan sistem lain, seperti sistem endokrin [78][79] dan saraf.[80][81][82] Sistem imun tubuh juga memainkan peran penting dalam perkembangan serta dalam perbaikan jaringan dan regenerasi.[83]
Hormon
Hormon dapat bertindak sebagai imunomodulator, yaitu mengubah sensitivitas sistem imun. Sebagai contoh, hormon seks wanita diketahui menstimulasi baik respons imun adaptif [84] dan respons imun bawaan.[85][86][87][88] Beberapa penyakit autoimun seperti lupus erythematosus sering menyerang wanita, dan mulainya serangan sering dengan pubertas. Sebaliknya, hormon seks pria seperti testosteron tampak menekan sistem imun.[89]
Vitamin D
Saat suatu sel T menjumpai patogen asing, pada beberapa kasus melibatkan reseptor vitamin D. Hal ini pada dasarnya merupakan alat pensinyalan yang memungkinkan sel T untuk berikatan dengan bentuk aktif vitamin D, suatu hormon steroid kalsitriol. Di sisi lain, sel T mengekspresikan CYP27B1, suatu enzim yang bertanggung jawab mengubah versi pra-hormon vitamin D, kalsidiol, menjadi versi hormon steroid, kalsitriol. Setelah mengikat dengan kalsitriol, sel T dapat melakukan fungsi yang diinginkan. Sel-sel sistem imun lainnya seperti sel dendritik, keratinosit, dan makrofag dikenal mengekspresikan CYP27B1 dan dengan demikian dapat mengaktifkan vitamin D kalsidiol.[90][91]
Diperkirakan bahwa penurunan progresif kadar hormon seiring bertambahnya usia juga menjadi salah satu faktor yang mengakibatkan pelemahan respons imun pada individu yang menua.[92] Penurunan fungsi kekebalan yang sehubungan dengan usia juga terkait dengan penurunan kadar vitamin D pada lansia. Seiring bertambahnya usia, ada dua hal yang secara negatif memengaruhi kadar vitamin D mereka. Pertama, mereka yang tinggal di dalam rumah akan lebih menurun tingkat aktivitasnya. Mereka mendapat lebih sedikit sinar matahari dan karenanya menghasilkan lebih sedikit kolekalsiferol melalui radiasi ultraungu B. Kedua, seiring bertambahnya usia, kulit menjadi berkurang kemampuannya memproduksi vitamin D.[93]
Tidur dan istirahat
Sistem imun bertambah dengan tidur dan beristirahat,[94] sebaliknya kurang tidur dapat merusak fungsi kekebalan tubuh.[95] Putaran umpan balik melibatkan sitokin seperti interleukin-1 dan TNF alfa yang diproduksi sebagai respons terhadap infeksi, tampaknya juga berperan dalam pengaturan tidur non-REM (non-rapid eye movement).[96] Dengan demikian respons imun terhadap infeksi dapat menyebabkan perubahan pada siklus tidur, termasuk peningkatan tidur gelombang lambat relatif terhadap tidur REM.[97]
Nutrisi dan diet
Kelebihan gizi dikaitkan dengan penyakit seperti diabetes dan obesitas, yang diketahui memengaruhi fungsi kekebalan tubuh. Malnutrisi yang lebih sedang, serta defisiensi mineral dan nutrisi tertentu, juga dapat membahayakan respons imun.[98] Demikian juga, kekurangan gizi pada janin dapat menyebabkan kerusakan sistem kekebalan seumur hidup.[99]
Perbaikan dan regenerasi
Sistem imun tubuh, khususnya sistem imun bawaan, memainkan peran yang menentukan dalam perbaikan jaringan setelah cedera.[100][101][102][103][104] Komponen kunci termasuk makrofag dan neutrofil, juga komponen seluler lainnya termasuk sel T γδ, sel limfoid bawaan (ILC), dan sel T regulator (Treg). Makrofag memainkan peran dominan dalam pemulihan homeostasis jaringan dengan membersihkan pecahan komponen seluler (debris sel), renovasi matriks ekstraseluler (extracellular matrix, ECM), dan penyintesisan berbagai sitokin dan faktor pertumbuhan.[105] Dalam konteks penyembuhan jaringan, sel T γδ epitel dendritik (dendritic epithelial γδT cell, DETC) merupakan bagian sel yang sudah dikarakterisasi dengan baik. DETC memiliki morfologi seperti sel dendritik pada kulit tikus, dan mereka merespons dalam beberapa jam terhadap kerusakan jaringan kulit dengan mengeluarkan kemokin dan TNF-α untuk menarik makrofag. Selain itu, DETC mempercepat perbaikan jaringan dengan mensekresi faktor pertumbuhan dan sitokin seperti IGF-1, KGF-1 (FGF-7), KGF-2 (FGF-10), IL-22, dan IL-17A.[106] Plastisitas sel-sel imun dan keseimbangan antara sinyal pro-inflamasi dan anti-inflamasi merupakan aspek penting dari perbaikan jaringan yang efisien.[104]
Gangguan pada imunitas
Sistem imun merupakan struktur yang luar biasa efektif dalam hal spesifisitas, indusibilitas, dan adaptasi. Namun, kegagalan pertahanan bisa juga terjadi dan dibagi menjadi tiga kelompok besar: imunodefisiensi, autoimunitas, dan hipersensitivitas.[107][108]
Imunodefisiensi
Imunodefisiensi terjadi ketika satu atau lebih komponen sistem imun tidak aktif. Kemampuan sistem imun untuk merespons patogen berkurang pada anak-anak dan orang tua, pada kasus orang tua disebabkan oleh imunosenesens.[109][110] Di negara-negara berkembang, penyebab melemahnya sistem imun yaitu obesitas, penyalahgunaan alkohol, dan penggunaan obat.[110] Namun, malnutrisi adalah penyebab paling umum yang menyebabkan imunodefisiensi di negara berkembang.[110] Diet dengan protein yang tidak mencukupi dikaitkan dengan gangguan imunitas seluler, aktivitas komplemen, fungsi fagosit, konsentrasi antibodi IgA, dan produksi sitokin. Selain itu, ketiadaan timus pada usia dini melalui mutasi genetik atau pengangkatan melalui operasi mengakibatkan imunodefisiensi yang parah dan kerentanan tinggi terhadap infeksi.[111]
Imunodefisiensi juga bisa muncul akibat faktor turunan atau perolehan (didapat). Penyakit granuloma kronis, yaitu penyakit dengan rendahnya kemampuan fagosit untuk menghancurkan patogen, adalah contoh dari imunodefisiensi turunan. Sementara itu, AIDS dan beberapa jenis kanker merupakan contoh imunodefisiensi dapatan.[112][113]
Autoimunitas
Autoimunitas adalah respons imun terlalu aktif termasuk fungsi imun yang tidak berfungsi baik sehingga berakhir pada gangguan autoimun. Sistem imun tidak mampu membedakan dengan tepat antara self dan non-self, sehingga dapat menyerang bagian dari tubuh. Pada keadaan kondisi yang normal, banyak sel T dan antibodi bereaksi dengan peptida self.[114] Terdapat sel khusus (terletak di timus dan sumsum tulang) yang menyajikan limfosit muda dengan antigen self yang dihasilkan pada tubuh dan untuk membunuh sel yang dianggap antigen self, akhirnya mencegah autoimunitas.[75] Beberapa contoh penyakit autoimun yaitu artritis rematoid, diabetes melitus tipe 1, penyakit Hashimoto, dan lupus eritematosus sistemik.[115]
Hipersensitivitas
Hipersensitivitas adalah respons imun yang berlebihan yang dapat merusak jaringan tubuh sendiri. Hipersensitivitas terbagi menjadi empat kelas (Tipe I – IV) berdasarkan mekanisme yang ikut serta dan lama waktu reaksi hipersensitif. Hipersensitivitas tipe I atau reaksi segera atau reaksi anafilaksis sering dikaitkan dengan alergi. Gejala dapat bervariasi dari ketidaknyamanan sampai kematian. Hipersensitivitas tipe I diperantarai oleh IgE, yang memicu degranulasi sel mast dan basofil saat IgE berikatan silang dengan antigen. Hipersensitivitas tipe II terjadi saat antibodi mengikat antigen sel inang dan menandai mereka untuk penghancuran. Jenis ini juga disebut hipersensitivitas sitotoksik, dan diperantarai oleh antibodi IgG dan IgM. Kompleks imun (kompleks antara antigen, protein komplemen dan antibodi IgG dan IgM) terkumpul pada berbagai jaringan yang memicu reaksi hipersensitivitas tipe III. Hipersensitivitas tipe IV (dikenal juga sebagai hipersensitivitas diperantarai sel atau hipersensitivitas jenis tertunda) biasanya membutuhkan waktu antara dua sampai tiga hari untuk berkembang. Reaksi tipe IV ikut serta dalam berbagai penyakit autoimun dan penyakit infeksi, tetapi juga dalam ikut serta dalam dermatitis kontak (misalnya disebabkan oleh racun tumbuhan jelatang). Reaksi tersebut diperantarai oleh sel T, monosit, dan makrofag.[116]
Manipulasi pada kedokteran
Respons imun dapat dimanipulasi untuk menekan respons yang tidak diinginkan akibat autoimunitas, alergi, atau penolakan transplantasi. Manipulasi juga dapat dilakukan untuk merangsang respons perlindungan terhadap patogen yang sebagian besar menghindari sistem imun (lihat imunisasi) atau kanker.
Obat imunosupresif
Obat imunosupresif digunakan untuk mengontrol gangguan autoimun atau inflamasi ketika terjadi kerusakan jaringan yang berlebihan, dan untuk mencegah penolakan transplantasi setelah transplantasi organ.[42][117]
Obat anti-inflamasi sering digunakan untuk mengontrol pengaruh peradangan. Glukokortikoid merupakan obat anti-inflamasi yang paling kuat, tetapi obat tersebut memiliki banyak efek samping seperti obesitas pusat, hiperglikemia, dan osteoporosis sehingga penggunaan obat tersebut harus diawasi dengan baik.[118] Obat anti-inflamasi dosis rendah sering digunakan bersamaan dengan obat sitotoksik atau obat imunosupresif seperti metotreksat atau azatioprin. Obat sitotoksik menghambat respons imun dengan membunuh sel yang membelah dengan cepat seperti sel T yang teraktivasi. Namun, pembunuhan sel dilakukan sembarangan sehingga sel-sel membelah dengan cepat lainnya, serta organ-organ lain pun terpengaruh, yang dapat menyebabkan efek samping berbahaya.[117] Obat imunosupresif seperti siklosporin mencegah sel T dari merespons sinyal dengan menghalangi transduksi sinyal.[119]
Imunostimulan
Pada pengobatan tradisional, beberapa obat-obatan tradisional dipercaya dapat menstimulasi imunitas, seperti ekinasea, akar manis, ginseng, astragalus, saga, bawang putih, sangitan, jamur shiitake, jamur lingzhi, hisop, dan madu. Penelitian telah menunjukan bahwa bahan-bahan tersebut dapat menstimulasi sistem imun,[120][121] walaupun cara kerja mereka belum sepenuhnya dimengerti.
Imunologi tumor
Peran penting sistem imun lainnya yaitu untuk menemukan dan menghancurkan tumor melalui mekanisme yang disebut pengawasan imun (immune surveillance). Sel tumor mengekspresikan antigen yang tidak ditemukan pada sel normal. Oleh sistem imun, antigen tersebut dianggap sebagai antigen asing dan keberadaannya mendorong sel imun untuk menyerang sel tumor tersebut. Antigen yang diekspresikan oleh tumor dapat berasal dari berbagai sumber,[123] misal dari virus onkogenik seperti papillomavirus yang menyebabkan kanker leher rahim,[124] sementara lainnya adalah protein organisme itu sendiri yang diekspresikan pada tingkat tinggi dibanding tingkat pada sel normal sehat. Salah satu contoh yaitu enzim tirosinase yang ketika diekspresikan pada tingkat tinggi, mengubah beberapa sel kulit (seperti melanosit) menjadi tumor yang disebut melanoma.[125][126] Sumber antigen tumor yang ketiga adalah protein yang secara normal penting untuk mengatur pertumbuhan dan daya hidup sel, tetapi protein ini mengalami mutasi menjadi kanker dan lalu menimbulkan molekul-molekul yang disebut onkogen.[123][127][128]
Respons utama sistem imun terhadap tumor yaitu untuk menghancurkan sel abnormal menggunakan sel T sitotoksik, kadang-kadang dengan bantuan sel T pembantu.[126][129] Antigen tumor disajikan pada molekul MHC kelas I dengan cara yang serupa dengan antigen virus, sehingga sel T sitotoksik dapat mengenali sel tumor sebagai sel abnormal.[130] Sel NK juga membunuh sel tumor dengan cara yang mirip, terutama jika sel tumor memiliki molekul MHC kelas I lebih sedikit pada permukaan daripada keadaan normal; hal ini merupakan fenomena umum pada tumor.[131] Terkadang antibodi dihasilkan untuk melawan sel tumor dan menghancurkannya melalui kerja sama dengan sistem komplemen.[127]
Makrofag memiliki peran ganda dalam karsinogenesis (proses perkembangan kanker). Peran tersebut yaitu dengan cara melawan aktivitas sitotoksik sel imun terhadap sel kanker atau dengan meningkatkan respons antitumor.[132] Makrofag terkait tumor (tumor-associated macrophage, TAM) dapat menghasilkan sitokin dan faktor pertumbuhan seperti TNF-alfa yang dapat memelihara perkembangan tumor atau mendorong plastisitas sifat seperti sel punca.[133] Sementara itu, sel tumor yang terus menerus terpapar keadaan hipoksia relatif ditambah dengan sitokin dan TNF-alfa menyebabkan turunnya produksi protein yang menghalangi metastasis sehingga mempercepat penyebaran sel kanker.[133]
Beberapa tumor menghindari sistem imun dan terus berkembang sampai menjadi kanker.[133][134] Sel tumor sering memiliki jumlah molekul MHC kelas I yang lebih rendah, sehingga dapat menghindari deteksi oleh sel T sitotoksik.[130] Beberapa sel tumor juga mengeluarkan produk yang mencegah respons imun; contohnya dengan menyekresikan sitokin TGF-β, yang menekan aktivitas makrofag dan limfosit.[135] Selain itu, toleransi imunologis dapat berkembang terhadap antigen tumor sehingga sistem imun tidak lagi menyerang sel tumor.[134]
Memori imunologi dan vaksinasi
Ketika limfosit telah aktif dan mulai melakukan replikasi, beberapa dari keturunan mereka menjadi sel memori berumur panjang. Sel memori akan mengingat setiap patogen yang pernah ditemui secara spesifik dan dapat melakukan respons lebih kuat jika patogen terdeteksi kembali. Hal ini disebut "adaptif" karena terjadi sepanjang hidup suatu individu dalam beradaptasi pada infeksi patogen dan menyiapkan sistem imun untuk tantangan berikutnya.[136]
Memori aktif jangka panjang didapat setelah terjadinya infeksi melalui proses pengaktifan sel B dan sel T. Imunitas aktif dapat juga dibuat melalui vaksinasi. Prinsip di balik vaksinasi (juga disebut imunisasi) yaitu untuk memperkenalkan antigen dari patogen untuk menstimulasi sistem imun dan mengembangkan imunitas spesifik melawan patogen tanpa menyebabkan penyakit yang berkaitan dengan organisme tersebut.[19] Induksi respons imun yang disengaja ini berhasil karena memanfaatkan spesifisitas alami sistem imun. Penyakit infeksi masih menjadi salah satu penyebab utama kematian pada populasi manusia, sehingga vaksinasi muncul sebagai manipulasi sistem imun manusia yang paling efektif.[42]
Kebanyakan vaksin virus berasal dari virus yang dilemahkan, sedangkan banyak vaksin bakteri berasal dari komponen aseluler dari mikroorganisme, termasuk komponen toksin yang tidak berbahaya. Karena banyak antigen berasal dari vaksin aseluler tidak menginduksi respons adaptf dengan kuat, maka kebanyakan vaksin bakteri disediakan dengan penambahan adjuvan yang mengaktifkan sel penyaji antigen pada sistem imun bawaan dan memaksimalkan imunogenisitas.[137]
Prediksi imunogenisitas
Obat-obat berukuran besar (>500 Da) dapat memicu aksi penetralan oleh respons imun, terutama jika obat digunakan berulang-ulang atau pada dosis yang lebih besar.[138] Hal ini membatasi obat-obat yang berbentuk peptida dan protein dengan ukuran besar (yang umumnya lebih besar dari 6000 Da). Pada beberapa kasus, obat tersebut tidak imunogenik, tetapi dapat diberikan bersamaan dengan senyawa imunogenik, seperti pada kasus paklitaksel ("Taxol") serta kombinasi oksaliplatin dan siklofosfamid.[139][140]
Metode komputerisasi telah dikembangkan untuk memprediksi imunogenisitas peptida dan protein, yang berguna dalam merancang antibodi untuk obat, menilai keganasan mutasi pada partikel pembungkus virus, dan validasi pengobatan calon obat dengan bahan peptida. Teknik zaman awal memanfaatkan kecenderungan bahwa asam amino hidrofil memiliki konsentrasi lebih tinggi pada daerah epitop.[141] Namun demikian, perkembangan-perkembangan terbaru lebih bersandar pada teknik pembelajaran mesin yang menggunakan basis data epitop yang diketahui ada (biasanya mengenai protein-protein virus yang sudah diteliti dengan baik) sebagai set pelatihan.[142]
Basis data yang dapat diakses publik telah dibuat untuk mengatalogkan epitop dari patogen yang diketahui bisa dikenali oleh sel B.[143] Penelitian berdasarkan bioinformatika terhadap imunogenisitas disebut juga imunoinformatika.[144] Imunoproteomik merupakan studi kumpulan besar protein (proteomika) yang terlibat dalam respons imun.
Evolusi dan mekanisme lainnya
Evolusi sistem imun
Sistem imun adaptif dengan berbagai komponennya tampaknya muncul pada vertebrata pertama, sementara invertebrata tidak menghasilkan limfosit atau respons humoral berupa antibodi.[145] Namun, banyak spesies yang memanfaatkan mekanisme-mekanisme yang agaknya merupakan pendahulu imunitas pada vertebrata. Sistem imun pun dimiliki oleh organisme yang paling sederhana, misalnya bakteri menggunakan mekanisme pertahanan unik yang disebut sistem modifikasi restriksi untuk melindungi diri dari patogen virus yang disebut bakteriofag.[146]
Prokariota juga memiliki imunitas adaptif melalui sistem yang menggunakan urutan CRISPR untuk mempertahankan fragmen genom dari bakteriofag yang pernah ditemui sebelumnya, yang memungkinkan prokariota menghalangi replikasi virus melalui mekanisme sejenis interferensi RNA.[147][148] Sistem imun yang bersifat menyerang juga terdapat pada eukariota uniseluler, tetapi belum banyak penelitian tentang peranan sistem tersebut dalam pertahanan.[149]
Reseptor pengenal pola merupakan protein yang digunakan oleh hampir semua organisme untuk mengidentifikasi molekul yang terkait dengan patogen. Peptida antimikrobial yang disebut defensin adalah komponen evolusioner respons imun bawaan yang ditemukan pada semua jenis hewan dan tumbuhan, serta mewakili bentuk utama imunitas sistemik invertebrata.[145] Sistem komplemen dan fagositik juga digunakan oleh hampir semua bentuk kehidupan invertebrata. Ribonuklease dan jalur interferensi RNA digunakan pada semua eukariot; keduanya diyakini memainkan peran pada respons imun terhadap virus.[150]
Tidak seperti hewan, tumbuhan tidak memiliki sel fagositik, tetapi kebanyakan respons imun tumbuhan melibatkan sinyal kimia bersifat sistemik yang dikirim ke seluruh bagian tumbuhan. Sel-sel tumbuhan merespons molekul yang terkait dengan patogen yang dikenal sebagai pola molekuler terkait patogen (PAMP).[151] Ketika bagian dari tumbuhan terinfeksi, tumbuhan menghasilkan respons hipersensitif, yaitu sel di tempat infeksi mengalami apoptosis dengan cepat untuk mencegah penyebaran penyakit ke bagian lainnya. Resistensi dapatan sistemik merupakan jenis respons pertahanan yang digunakan oleh tumbuhan agar resisten terhadap penyebab infeksi.[152] Mekanisme peredaman RNA sangat penting pada sistem respons sistemik ini karena dapat menghalangi replikasi virus.[153]
Imunitas adaptif alternatif
Evolusi sistem imun adaptif terjadi pada nenek moyang vertebrata berahang. Banyak molekul klasik pada sistem imun adaptif (seperti antibodi dan reseptor sel T) hanya dimiliki vertebrata berahang. Namun, molekul berbeda yang berasal dari limfosit ditemukan pada vertebrata tak berahang primitif, seperti ikan lamprey dan remang. Hewan tersebut memiliki sejumlah molekul disebut reseptor limfosit variabel, mirip reseptor antigen pada vertebrata berahang, yang dihasilkan dari segelintir gen (satu atau dua). Molekul tersebut dipercaya berikatan pada patogen dengan cara yang sama dengan antibodi dan dengan tingkat spesifisitas yang sama.[154]
Manipulasi oleh patogen
Keberhasilan patogen bergantung pada kemampuannya untuk menghindar dari respons imun. Oleh karena itu, patogen telah mengembangkan beberapa metode yang menyebabkan mereka dapat menginfeksi inang, sementara patogen menghindari deteksi dan kehancuran akibat sistem imun.[155] Bakteri sering menembus penghalang fisik dengan mengeluarkan enzim yang bisa menghancurkan penghalang tersebut, contohnya dengan menggunakan sistem sekresi tipe II.[156] Selain itu, patogen dapat menggunakan sistem sekresi tipe III, yaitu mereka dapat memasukan tuba berongga pada sel inang, yang menyediakan saluran langsung untuk protein agar dapat bergerak dari patogen ke inang. Protein yang dikirim melalui tuba sering digunakan untuk membuat tidak aktif pertahanan tubuh.[157]
Strategi menghindar digunakan oleh beberapa patogen untuk menghindari sistem imun bawaan yaitu bersembunyi dalam sel inang (juga disebut patogenesis intraseluler). Dalam hal ini, patogen menghabiskan sebagian besar siklus hidupnya dalam sel inang yang dilindungi dari kontak langsung dengan sel imun, antibodi, dan sistem komplemen. Beberapa contoh patogen intraseluler termasuk virus, bakteri Salmonella yang terdapat pada makanan beracun, dan parasit eukariot yang menyebabkan malaria (Plasmodium falciparum) dan leismaniasis (Leishmania spp.). Bakteri lain, seperti Mycobacterium tuberculosis, hidup di dalam kapsul pelindung yang mencegah lisis oleh sistem komplemen.[158] Banyak patogen mengeluarkan senyawa yang melemahkan respons imun atau mengarahkan respons imun ke arah yang salah.[155] Beberapa bakteri membentuk biofilm untuk melindungi diri mereka dari sel dan protein sistem imun. Biofilm dapat ditemui pada banyak infeksi, seperti infeksi Pseudomonas aeruginosa kronis dan Burkholderia cenocepacia, yang merupakan penanda dari infeksi fibrosis sistik.[159] Bakteri lain menghasilkan protein permukaan yang mengikat pada antibodi, mengubah mereka menjadi tidak efektif, contohnya Streptococcus (protein G), Staphylococcus aureus (protein A), dan Peptostreptococcus magnus (protein L).[160]
Mekanisme yang digunakan oleh virus untuk menghindari sistem imun adaptif adalah lebih rumit. Pendekatan paling sederhana yaitu dengan cepat mengubah epitop yang tidak esensial (asam amino dan gula) pada permukaannya, sementara terus menyembunyikan epitop esensial. Proses ini dinamakan variasi antigenik. Contohnya yaitu HIV, yang bermutasi dengan cepat, sehingga protein pada selubung virus yang esensial untuk masuk pada sel target secara terus menerus berubah. Perubahan tersebut bisa jadi adalah sebab gagalnya vaksin yang diarahkan pada virus tersebut.[161] Parasit Trypanosoma brucei menggunakan strategi yang serupa, selalu mengubah protein permukaan sehingga selangkah lebih maju dari respons antibodi.[162] Strategi lainnya yaitu menutup antigen dari molekul inang untuk menghindari deteksi oleh sistem imun. Pada HIV, selubung yang menutupi virion dibentuk dari membran paling luar dari sel inang, membuat sistem imun kesulitan untuk mengidentifikasikan mereka sebagai benda asing.[163]
Lihat pula
Referensi
- ^ O'Byrne KJ, Dalgleish AG (Aug 2001). "Chronic immune activation and inflammation as the cause of malignancy". British Journal of Cancer. 85 (4): 473–83. doi:10.1054/bjoc.2001.1943. PMC 2364095 . PMID 11506482.
- ^ Retief F, Cilliers L (1998). "The epidemic of Athens, 430-426 BC". S Afr Med J. 88 (1): 50–3. PMID 9539938.
- ^ a b Doherty, M; Robertson, M (2004-12). "Some early Trends in Immunology". Trends in Immunology. 25 (12): 623–631. doi:10.1016/j.it.2004.10.008. ISSN 1471-4906. Diarsipkan dari versi asli tanggal 2019-01-21.
- ^ Plotkin S (2005). "Vaccines: past, present and future". Nat Med. 11 (4 Suppl): S5–11. PMID 15812490.
- ^ Karamanou, Marianna; Panayiotakopoulos, George; Tsoucalas, Gregory; Kousoulis, Antonis A.; Androutsos, George (2012-3). "From miasmas to germs: a historical approach to theories of infectious disease transmission". Le Infezioni in Medicina: Rivista Periodica Di Eziologia, Epidemiologia, Diagnostica, Clinica E Terapia Delle Patologie Infettive. 20 (1): 58–62. ISSN 1124-9390. PMID 22475662. Diarsipkan dari versi asli tanggal 2019-01-26. Diakses tanggal 2019-01-26.
- ^ The Nobel Prize in Physiology or Medicine 1905 Diarsipkan 2006-12-10 di Wayback Machine. Nobelprize.org, Diakses 8 Januari 2007.
- ^ Major Walter Reed, Medical Corps, U.S. Army Walter Reed Army Medical Center. Diakses 8 Januari 2007.
- ^ Doherty, Michelle; Robertson, Morag J. (2004-12). "Some early Trends in Immunology". Trends in Immunology. 25 (12): 623–631. doi:10.1016/j.it.2004.10.008. ISSN 1471-4906. PMID 15530829. Diarsipkan dari versi asli tanggal 2019-01-19. Diakses tanggal 2019-01-19.
- ^ The Nobel Prize in Physiology or Medicine 1908 Diarsipkan 2007-02-19 di Wayback Machine. Nobelprize.org, Diakses 8 Januari 2007.
- ^ a b Litman G, Cannon J, Dishaw L (2005). "Reconstructing immune phylogeny: new perspectives". Nat Rev Immunol. 5 (11): 866–79. PMID 16261174.
- ^ Kurosaki T, Kometani K, Ise W (Maret 2015). "Memory B cells". Nature Reviews. Immunology. 15 (3): 149–59. doi:10.1038/nri3802. PMID 25677494.
- ^ Forthal, Donald N. (2014-08-15). "Functions of Antibodies". Microbiology Spectrum. 2 (4): 1–17. ISSN 2165-0497. PMC 4159104 . PMID 25215264. Diarsipkan dari versi asli tanggal 2019-01-21. Diakses tanggal 2019-01-21.
- ^ Smith A.D. (Ed) Oxford dictionary of biochemistry and molecular biology. (2000) [1997] Oxford University Press. ISBN 0-19-854768-4, hlm. 592
- ^ Saji F, Samejima Y, Kamiura S, Koyama M (1999). "Dynamics of immunoglobulins at the feto-maternal interface" (PDF). Rev Reprod. 4 (2): 81–9. PMID 10357095. Diarsipkan dari versi asli (PDF) tanggal 2008-06-24. Diakses tanggal 2007-11-09.
- ^ Van de Perre P (2003). "Transfer of antibody via mother's milk". Vaccine. 21 (24): 3374–6. PMID 12850343.
- ^ Keller, Margaret A. and E. Richard Stiehm (2000). "Passive Immunity in Prevention and Treatment of Infectious Diseases". Clinical Microbiology Reviews. 13 (4): 602–614. PMID 11023960. Diarsipkan dari versi asli tanggal 2020-04-08. Diakses tanggal 2007-11-09.
- ^ Medzhitov R (Oct 2007). "Recognition of microorganisms and activation of the immune response". Nature. 449 (7164): 819–26. Bibcode:2007Natur.449..819M. doi:10.1038/nature06246. PMID 17943118.
- ^ Matzinger P (Apr 2002). "The danger model: a renewed sense of self" (PDF). Science. 296 (5566): 301–5. Bibcode:2002Sci...296..301M. doi:10.1126/science.1071059. PMID 11951032. Diarsipkan (PDF) dari versi asli tanggal 2007-04-17. Diakses tanggal 2022-02-09.
- ^ a b c d e Alberts, Bruce (2017). Molecular Biology of the Cell, Sixth Edition. New York and London: Garland Science. ISBN 978-0-8153-4464-3.
- ^ Boyton R, Openshaw P. "Pulmonary defences to acute respiratory infection". Br Med Bull. 61: 1–12. PMID 11997295.
- ^ Agerberth B, Gudmundsson G. "Host antimicrobial defence peptides in human disease". Curr Top Microbiol Immunol. 306: 67–90. PMID 16909918.
- ^ Moreau J, Girgis D, Hume E, Dajcs J, Austin M, O'Callaghan R (2001). "Phospholipase A(2) in rabbit tears: a host defense against Staphylococcus aureus". Invest Ophthalmol Vis Sci. 42 (10): 2347–54. PMID 11527949. Diarsipkan dari versi asli tanggal 2008-04-17. Diakses tanggal 2007-11-05.
- ^ Hankiewicz J, Swierczek E (1974). "Lysozyme in human body fluids". Clin Chim Acta. 57 (3): 205–9. PMID 4434640.
- ^ Fair W, Couch J, Wehner N (1976). "Prostatic antibacterial factor. Identity and significance". Urology. 7 (2): 169–77. PMID 54972.
- ^ Yenugu S, Hamil K, Birse C, Ruben S, French F, Hall S (2003). "Antibacterial properties of the sperm-binding proteins and peptides of human epididymis 2 (HE2) family; salt sensitivity, structural dependence and their interaction with outer and cytoplasmic membranes of Escherichia coli". Biochem J. 372 (Pt 2): 473–83. PMID 12628001. Diarsipkan (PDF) dari versi asli tanggal 2019-09-16. Diakses tanggal 2007-11-05.
- ^ "Proteolytic enzyme | enzyme". Encyclopedia Britannica (dalam bahasa Inggris). Diarsipkan dari versi asli tanggal 2022-05-13. Diakses tanggal 2019-01-31.
- ^ Gorbach S (1990). "Lactic acid bacteria and human health". Ann Med. 22 (1): 37–41. PMID 2109988.
- ^ Hill L, Embil J (1986). "Vaginitis: current microbiologic and clinical concepts". CMAJ. 134 (4): 321–31. PMID 3510698.
- ^ Reid G, Bruce A (2003). "Urogenital infections in women: can probiotics help?". Postgrad Med J. 79 (934): 428–32. PMID 12954951. Diarsipkan dari versi asli tanggal 2008-05-05. Diakses tanggal 2007-11-05.
- ^ Salminen S, Gueimonde M, Isolauri E (2005). "Probiotics that modify disease risk". J Nutr. 135 (5): 1294–8. PMID 15867327. Diarsipkan dari versi asli tanggal 2008-03-23. Diakses tanggal 2007-11-05.
- ^ Reid G, Jass J, Sebulsky M, McCormick J (2003). "Potential uses of probiotics in clinical practice". Clin Microbiol Rev. 16 (4): 658–72. PMID 14557292.
- ^ Kawai T, Akira S (2006). "Innate immune recognition of viral infection". Nat Immunol. 7 (2): 131–7. PMID 16424890.
- ^ Miller, SB (2006). "Prostaglandins in Health and Disease: An Overview". Seminars in Arthritis and Rheumatism. 36 (1): 37–49. PMID 16887467.
- ^ Ogawa Y, Calhoun WJ. (2006). "The role of leukotrienes in airway inflammation". J Allergy Clin Immunol. 118 (4): 789–98. PMID 17030228.
- ^ Le Y, Zhou Y, Iribarren P, Wang J (2004). "Chemokines and chemokine receptors: their manifold roles in homeostasis and disease" (PDF). Cell Mol Immunol. 1 (2): 95–104. PMID 16212895. Diarsipkan (PDF) dari versi asli tanggal 2008-04-14. Diakses tanggal 2007-11-09.
- ^ Martin P, Leibovich S (2005). "Inflammatory cells during wound repair: the good, the bad and the ugly". Trends Cell Biol. 15 (11): 599–607. PMID 16202600.
- ^ a b Rus H, Cudrici C, Niculescu F (2005). "The role of the complement system in innate immunity". Immunol Res. 33 (2): 103–12. PMID 16234578.
- ^ Nonaka M, Kimura A (2006). "Genomic view of the evolution of the complement system". Immunogenetics. 58 (9): 701–13. PMID 16896831.
- ^ Liszewski M, Farries T, Lublin D, Rooney I, Atkinson J. "Control of the complement system". Adv Immunol. 61: 201–83. PMID 8834497.
- ^ Sim R, Tsiftsoglou S (2004). "Proteases of the complement system" (PDF). Biochem Soc Trans. 32 (Pt 1): 21–7. PMID 14748705.
- ^ Iwasaki A, Medzhitov R. (2015). "Control of adaptive immunity by the innate immune system". Nat Immunol. 16 (4): 343–53. PMID 25789684.
- ^ a b c d e f Murphy, Kenneth (2017). Janeway's Immunobiology (edisi ke-9). New York and London: Garland Science. ISBN 978-0-8153-4551-0. Diarsipkan dari versi asli tanggal 2023-03-27. Diakses tanggal 2019-01-13.
- ^ Ryter A (1985). "Relationship between ultrastructure and specific functions of macrophages". Comp Immunol Microbiol Infect Dis. 8 (2): 119–33. PMID 3910340.
- ^ Langermans J, Hazenbos W, van Furth R (1994). "Antimicrobial functions of mononuclear phagocytes". J Immunol Methods. 174 (1–2): 185–94. PMID 8083520.
- ^ May R, Machesky L (2001). "Phagocytosis and the actin cytoskeleton". J Cell Sci. 114 (Pt 6): 1061–77. PMID 11228151. Diarsipkan dari versi asli tanggal 2008-05-03. Diakses tanggal 2007-11-09.
- ^ Salzet M, Tasiemski A, Cooper E (2006). "Innate immunity in lophotrochozoans: the annelids". Curr Pharm Des. 12 (24): 3043–50. PMID 16918433.
- ^ Zen K, Parkos C (2003). "Leukocyte-epithelial interactions". Curr Opin Cell Biol. 15 (5): 557–64. PMID 14519390.
- ^ a b Stvrtinová, Viera (1995). Inflammation and Fever from Pathophysiology: Principles of Disease. Computing Centre, Slovak Academy of Sciences: Academic Electronic Press. Diarsipkan dari versi asli tanggal 2001-07-11. Diakses tanggal 2007-01-01.
- ^ Edwards, Steven W.; Bucknall, Roger C.; Moots, Robert J.; Wright, Helen L. (2010-09-01). "Neutrophil function in inflammation and inflammatory diseases". Rheumatology (dalam bahasa Inggris). 49 (9): 1618–1631. doi:10.1093/rheumatology/keq045. ISSN 1462-0324. Diarsipkan dari versi asli tanggal 2019-01-20. Diakses tanggal 2019-01-20.
- ^ Murray PJ, Wynn TA (2011). "Protective and pathogenic functions of macrophage subsets". Nat Rev Immunol. 11 (1): 723–37. PMID 15283665.
- ^ a b Guermonprez P, Valladeau J, Zitvogel L, Théry C, Amigorena S. "Antigen presentation and T cell stimulation by dendritic cells". Annu Rev Immunol. 20: 621–67. PMID 11861614.
- ^ Gabrielli S, Ortolani C, Del Zotto G, Luchetti F, Canonico B, Buccella F, Artico M, Papa S, Zamai L (2016). "The Memories of NK Cells: Innate-Adaptive Immune Intrinsic Crosstalk". Journal of Immunology Research. 2016: 1376595. doi:10.1155/2016/1376595. PMC 5204097 . PMID 28078307.
- ^ Middleton D, Curran M, Maxwell L (2002). "Natural killer cells and their receptors". Transpl Immunol. 10 (2–3): 147–64. PMID 12216946.
- ^ Rajalingam R (2012). "Overview of the killer cell immunoglobulin-like receptor system". Methods in Molecular Biology. Methods in Molecular Biology™. 882: 391–414. doi:10.1007/978-1-61779-842-9_23. ISBN 978-1-61779-841-2. PMID 22665247.
- ^ Krystel-Whittemore, Melissa; Dileepan, Kottarappat N.; Wood, John G. (2016). "Mast Cell: A Multi-Functional Master Cell". Frontiers in Immunology. 6. doi:10.3389/fimmu.2015.00620. ISSN 1664-3224. PMC 4701915 . PMID 26779180. Diarsipkan dari versi asli tanggal 2023-03-27. Diakses tanggal 2022-04-06.
- ^ Krishnaswamy G, Ajitawi O, Chi D. "The human mast cell: an overview". Methods Mol Biol. 315: 13–34. PMID 16110146.
- ^ da Silva, Elaine Zayas Marcelino; Jamur, Maria Célia; Oliver, Constance (2014-10). "Mast Cell Function: A New Vision of an Old Cell". Journal of Histochemistry & Cytochemistry (dalam bahasa Inggris). 62 (10): 698–738. doi:10.1369/0022155414545334. ISSN 0022-1554. PMC 4230976 . PMID 25062998. Diarsipkan dari versi asli tanggal 2022-06-05. Diakses tanggal 2022-04-06.
- ^ Galli, Stephen J.; Tsai, Mindy (2010-07). "Mast cells in allergy and infection: Versatile effector and regulatory cells in innate and adaptive immunity". European Journal of Immunology (dalam bahasa Inggris). 40 (7): 1843–1851. doi:10.1002/eji.201040559. PMC 3581154 . PMID 20583030. Diarsipkan dari versi asli tanggal 2022-04-06. Diakses tanggal 2022-04-06.
- ^ Kariyawasam H, Robinson D (2006). "The eosinophil: the cell and its weapons, the cytokines, its locations". Semin Respir Crit Care Med. 27 (2): 117–27. PMID 16612762.
- ^ Spits, Hergen; Cupedo, Tom (2012). "Innate lymphoid cells: emerging insights in development, lineage relationships, and function". Annual Review of Immunology. 30: 647–675. doi:10.1146/annurev-immunol-020711-075053. PMID 22224763.
- ^ Walker, Jennifer A; Jillian L. Barlow; Andrew N. J. McKenzie (2013). "Innate lymphoid cells—how did we miss them". Nature Reviews Immunology. 13 (2): 75–87. doi:10.1038/nri3349. ISSN 1474-1733. Diarsipkan dari versi asli tanggal 2013-11-05. Diakses tanggal 2013-08-03.
- ^ Pancer Z, Cooper M. "The evolution of adaptive immunity". Annu Rev Immunol. 24: 497–518. PMID 16551257.
- ^ Shlomchik, Mark J.; Walport, Mark; Travers, Paul; Charles A Janeway, Jr (2001). "T Cell-Mediated Immunity". Immunobiology: The Immune System in Health and Disease. 5th edition (dalam bahasa Inggris). Diarsipkan dari versi asli tanggal 2020-05-31. Diakses tanggal 2019-01-31.
- ^ Holtmeier W, Kabelitz D. "gammadelta T cells link innate and adaptive immune responses". Chem Immunol Allergy. 86: 151–83. PMID 15976493.
- ^ a b "Understanding the Immune System: How it Works" (PDF). National Institute of Allergy and Infectious Diseases (NIAID). Archived from the original on 2009-01-17. Diakses tanggal 2007-01-01.
- ^ Harty J, Tvinnereim A, White D. "CD8+ T cell effector mechanisms in resistance to infection". Annu Rev Immunol. 18: 275–308. PMID 10837060.
- ^ a b Radoja S, Frey A, Vukmanovic S (2006). "T-cell receptor signaling events triggering granule exocytosis". Crit Rev Immunol. 26 (3): 265–90. PMID 16928189.
- ^ Abbas A, Murphy K, Sher A (1996). "Functional diversity of helper T lymphocytes". Nature. 383 (6603): 787–93. PMID 8893001.
- ^ McHeyzer-Williams L, Malherbe L, McHeyzer-Williams M. "Helper T cell-regulated B cell immunity". Curr Top Microbiol Immunol. 311: 59–83. PMID 17048705.
- ^ Romagnani, S. (1991). "Type 1 T helper and type 2 T helper cells: functions, regulation and role in protection and disease". International Journal of Clinical & Laboratory Research. 21 (2): 152–158. ISSN 0940-5437. PMID 1687725. Diarsipkan dari versi asli tanggal 2019-02-01. Diakses tanggal 2019-01-31.
- ^ Kovacs B, Maus M, Riley J, Derimanov G, Koretzky G, June C, Finkel T (2002). "Human CD8+ T cells do not require the polarization of lipid rafts for activation and proliferation". Proc Natl Acad Sci U S A. 99 (23): 15006–11. PMID 12419850. Diarsipkan dari versi asli tanggal 2008-10-15. Diakses tanggal 2007-11-09.
- ^ Grewal I, Flavell R. "CD40 and CD154 in cell-mediated immunity". Annu Rev Immunol. 16: 111–35. PMID 9597126.
- ^ Girardi M (2006). "Immunosurveillance and immunoregulation by γδ T cells". J Invest Dermatol. 126 (1): 25–31. PMID 16417214.
- ^ Holtmeier W, Kabelitz D (2005). "γδ T cells link innate and adaptive immune responses". Chem Immunol Allergy. 86: 151–183. PMID 15976493.
- ^ a b Sproul T, Cheng P, Dykstra M, Pierce S (2000). "A role for MHC class II antigen processing in B cell development". Int Rev Immunol. 19 (2–3): 139–55. PMID 10763706.
- ^ Kehry M, Hodgkin P (1994). "B-cell activation by helper T-cell membranes". Crit Rev Immunol. 14 (3–4): 221–38. PMID 7538767.
- ^ Baldridge JR, Buchmeier MJ (1992). "Mechanisms of antibody-mediated protection against lymphocytic choriomeningitis virus infection: mother-to-baby transfer of humoral protection". J. Virol. 66 (7): 4252–7. PMID 1376367.
- ^ WICK, G.; HU, Y.; SCHWARZ, S.; KROEMER, G. (1993-10-01). "Immunoendocrine Communication via the Hypothalamo-Pituitary-Adrenal Axis in Autoimmune Diseases*". Endocrine Reviews (dalam bahasa Inggris). 14 (5): 539–563. doi:10.1210/edrv-14-5-539. ISSN 0163-769X. Diarsipkan dari versi asli tanggal 2021-05-26. Diakses tanggal 2022-02-09.
- ^ Kroemer, Guido; Brezinschek, Hans-Peter; Faessler, Reinhard; Schauenstein, Konrad; Wick, Georg (1988-01-01). "Physiology and pathology of an immunoendocrine feedback loop". Immunology Today. 9 (6): 163–165. doi:10.1016/0167-5699(88)91289-3. Diarsipkan dari versi asli tanggal 2018-11-07. Diakses tanggal 2022-02-09.
- ^ Trakhtenberg, Ephraim F.; Goldberg, Jeffrey L. (2011-10-07). "Neuroimmune Communication". Science (dalam bahasa Inggris). 334 (6052): 47–48. Bibcode:2011Sci...334...47T. doi:10.1126/science.1213099. ISSN 0036-8075. PMID 21980100. Diarsipkan dari versi asli tanggal 2021-05-25. Diakses tanggal 2022-02-09.
- ^ Veiga-Fernandes, Henrique; Mucida, Daniel (2016-05-05). "Neuro-Immune Interactions at Barrier Surfaces". Cell. 165 (4): 801–811. doi:10.1016/j.cell.2016.04.041. ISSN 1097-4172. PMC 4871617 . PMID 27153494.
- ^ "Neuroimmune communication". Nature Neuroscience (dalam bahasa Inggris). 20 (2): 127–127. Februari 2017. doi:10.1038/nn.4496. ISSN 1097-6256. Diarsipkan dari versi asli tanggal 2017-07-05. Diakses tanggal 2022-02-09.
- ^ Olson, Eric N.; Aurora, Arin B. (2014-07-03). "Immune Modulation of Stem Cells and Regeneration". Cell Stem Cell (dalam bahasa English). 15 (1): 14–25. doi:10.1016/j.stem.2014.06.009. ISSN 1934-5909. PMC 4131296 . PMID 24996166. Diarsipkan dari versi asli tanggal 2023-03-27. Diakses tanggal 2019-01-31.
- ^ Wira, CR (2004). "Endocrine regulation of the mucosal immune system in the female reproductive tract". Dalam In: Ogra PL, Mestecky J, Lamm ME, Strober W, McGhee JR, Bienenstock J (eds.). Mucosal Immunology. San Francisco: Elsevier. ISBN 0-12-491543-4.
- ^ Lang, TJ (2004). "Estrogen as an immunomodulator". Clin Immunol. 113: 224–230. PMID 15507385.
- ^ Moriyama, A (1999). "Secretory leukocyte protease inhibitor (SLPI) concentrations in cervical mucus of women with normal menstrual cycle". Molecular Human Reproduction. 5: 656–661. PMID 10381821. Diarsipkan dari versi asli tanggal 2008-10-06. Diakses tanggal 2007-11-09.
- ^ Cutolo, M (2004). "Sex hormones influence on the immune system: basic and clinical aspects in autoimmunity". Lupus. 13: 635–638. PMID 15485092.
- ^ King, AE (2000). "Presence of secretory leukocyte protease inhibitor in human endometrium and first trimester decidua suggests an antibacterial role". Molecular Human Reproduction. 6: 191–196. PMID 10655462. Diarsipkan dari versi asli tanggal 2008-09-06. Diakses tanggal 2007-11-09.
- ^ Fimmel (2005). "Influence of physiological androgen levels on wound healing and immune status in men". Aging Male. 8: 166–174. PMID 16390741.
- ^ von Essen MR, Kongsbak M, Schjerling P, Olgaard K, Odum N, Geisler C (Apr 2010). "Vitamin D controls T cell antigen receptor signaling and activation of human T cells". Nature Immunology. 11 (4): 344–9. doi:10.1038/ni.1851. PMID 20208539. Diarsipkan dari versi asli tanggal 2017-06-21. Diakses tanggal 2022-02-09.
- ^ Sigmundsdottir H, Pan J, Debes GF, Alt C, Habtezion A, Soler D, Butcher EC (Mar 2007). "DCs metabolize sunlight-induced vitamin D3 to 'program' T cell attraction to the epidermal chemokine CCL27". Nature Immunology. 8 (3): 285–93. doi:10.1038/ni1433. PMID 17259988.
- ^ Hertoghe T (Dec 2005). "The "multiple hormone deficiency" theory of aging: is human senescence caused mainly by multiple hormone deficiencies?". Annals of the New York Academy of Sciences. 1057 (1): 448–65. Bibcode:2005NYASA1057..448H. doi:10.1196/annals.1322.035. PMID 16399912.
- ^ Mosekilde L (Mar 2005). "Vitamin D and the elderly". Clinical Endocrinology. 62 (3): 265–81. doi:10.1111/j.1365-2265.2005.02226.x. PMID 15730407.
- ^ Lange, T (2003). "Sleep Enhances the Human Antibody response to Hepatitis A Vaccination". Psychosomatic Medicine. 65: 831–835. PMID 14508028. Diarsipkan dari versi asli tanggal 2008-04-10. Diakses tanggal 2007-11-09.
- ^ Bryant PA, Trinder J, Curtis N (Jun 2004). "Sick and tired: Does sleep have a vital role in the immune system?". Nature Reviews. Immunology. 4 (6): 457–67. doi:10.1038/nri1369. PMID 15173834.
- ^ Krueger JM, Majde JA (Mei 2003). "Humoral links between sleep and the immune system: research issues". Annals of the New York Academy of Sciences. 992 (1): 9–20. Bibcode:2003NYASA.992....9K. doi:10.1111/j.1749-6632.2003.tb03133.x. PMID 12794042.
- ^ Majde JA, Krueger JM (Dec 2005). "Links between the innate immune system and sleep". The Journal of Allergy and Clinical Immunology. 116 (6): 1188–98. doi:10.1016/j.jaci.2005.08.005. PMID 16337444.
- ^ R.M. Suskind, C.L. Lachney, J.N. Udall, Jr., "Malnutrition and the Immune Response Diarsipkan 2023-03-27 di Wayback Machine.", in: Dairy products in human health and nutrition, M. Serrano-Ríos, ed., CRC Press, 1994, pp. 285–300
- ^ Langley-Evans SC, Carrington LJ (2006). "Diet and the developing immune system". Lupus. 15 (11): 746–52. doi:10.1177/0961203306070001. PMID 17153845.
- ^ Park, Julie E.; Barbul, Adrian (2004-05-01). "Understanding the role of immune regulation in wound healing". The American Journal of Surgery (dalam bahasa English). 187 (5): S11–S16. doi:10.1016/s0002-9610(03)00296-4. ISSN 0002-9610. PMID 15147986. Diarsipkan dari versi asli tanggal 2020-03-31. Diakses tanggal 2019-01-13.
- ^ Burzyn, Dalia; Kuswanto, Wilson; Kolodin, Dmitriy; Shadrach, Jennifer L.; Cerletti, Massimiliano; Jang, Young; Sefik, Esen; Tan, Tze Guan; Wagers, Amy J. (2013-12-05). "A Special Population of Regulatory T Cells Potentiates Muscle Repair". Cell (dalam bahasa English). 155 (6): 1282–1295. doi:10.1016/j.cell.2013.10.054. ISSN 0092-8674. PMC 3894749 . PMID 24315098. Diarsipkan dari versi asli tanggal 2022-02-04. Diakses tanggal 2022-02-09.
- ^ Leoni, G.; Neumann, P.-A.; Sumagin, R.; Denning, T. L.; Nusrat, A. (September 2015). "Wound repair: role of immune–epithelial interactions". Mucosal Immunology (dalam bahasa Inggris). 8 (5): 959–968. doi:10.1038/mi.2015.63. ISSN 1933-0219. PMC 4916915 . PMID 26174765. Diarsipkan dari versi asli tanggal 2017-07-16. Diakses tanggal 2022-02-09.
- ^ Wynn, Thomas A.; Vannella, Kevin M. (2016-03-15). "Macrophages in Tissue Repair, Regeneration, and Fibrosis". Immunity (dalam bahasa English). 44 (3): 450–462. doi:10.1016/j.immuni.2016.02.015. ISSN 1074-7613. PMC 4794754 . PMID 26982353. Diarsipkan dari versi asli tanggal 2022-02-05. Diakses tanggal 2022-02-09.
- ^ a b Laurent, Paôline; Jolivel, Valérie; Manicki, Pauline; Chiu, Lynn; Contin-Bordes, Cécile; Truchetet, Marie-Elise; Pradeu, Thomas (2017). "Immune-Mediated Repair: A Matter of Plasticity". Frontiers in Immunology (dalam bahasa English). 8. doi:10.3389/fimmu.2017.00454. ISSN 1664-3224. PMC 5403426 . PMID 28484454. Diarsipkan dari versi asli tanggal 2023-03-27. Diakses tanggal 2022-02-09.
- ^ Julier, Ziad; Park, Anthony J.; Briquez, Priscilla S.; Martino, Mikaël M. (2017-04-15). "Promoting tissue regeneration by modulating the immune system". Acta Biomaterialia. 53: 13–28. doi:10.1016/j.actbio.2017.01.056. ISSN 1742-7061. Diarsipkan dari versi asli tanggal 2021-05-14. Diakses tanggal 2019-01-21.
- ^ Ramirez, Kevin; Witherden, Deborah A.; Havran, Wendy L. (2015-07-01). "All hands on DE(T)C: Epithelial-resident γδ T cells respond to tissue injury". Cellular Immunology. Gamma delta T cells: 30 years post-discovery. 296 (1): 57–61. doi:10.1016/j.cellimm.2015.04.003. ISSN 0008-8749. PMC 4466205 . PMID 25958272.
- ^ Giardino, Giuliana; Gallo, Vera; Prencipe, Rosaria; Gaudino, Giovanni; Romano, Roberta; De Cataldis, Marco; Lorello, Paola; Palamaro, Loredana; Di Giacomo, Chiara (2016). "Unbalanced Immune System: Immunodeficiencies and Autoimmunity". Frontiers in Pediatrics. 4: 107. doi:10.3389/fped.2016.00107. ISSN 2296-2360. PMC 5052255 . PMID 27766253. Diarsipkan dari versi asli tanggal 2019-02-01. Diakses tanggal 2019-01-31.
- ^ Weiss, R. B. (1992-10). "Hypersensitivity reactions". Seminars in Oncology. 19 (5): 458–477. ISSN 0093-7754. PMID 1384149. Diarsipkan dari versi asli tanggal 2019-02-01. Diakses tanggal 2019-01-31.
- ^ Aw D, Silva A, Palmer D (2007). "Immunosenescence: emerging challenges for an ageing population". Immunology. 120 (4): 435–446. PMID 17313487.
- ^ a b c Chandra, RK (1997). "Nutrition and the immune system: an introduction". American Journal of Clinical Nutrition. Vol 66: 460S–463S. PMID 9250133. Diarsipkan dari versi asli tanggal 2008-04-22. Diakses tanggal 2007-11-09.
- ^ Miller JF (Jul 2002). "The discovery of thymus function and of thymus-derived lymphocytes". Immunological Reviews. 185 (1): 7–14. doi:10.1034/j.1600-065X.2002.18502.x. PMID 12190917.
- ^ Joos L, Tamm M (2005). "Breakdown of pulmonary host defense in the immunocompromised host: cancer chemotherapy". Proc Am Thorac Soc. 2 (5): 445–8. PMID 16322598. Diarsipkan dari versi asli tanggal 2008-04-29. Diakses tanggal 2007-11-09.
- ^ Copeland K, Heeney J (1996). "T helper cell activation and human retroviral pathogenesis". Microbiol Rev. 60 (4): 722–42. PMID 8987361.
- ^ Miller J (1993). "Self-nonself discrimination and tolerance in T and B lymphocytes". Immunol Res. 12 (2): 115–30. PMID 8254222.
- ^ Cho, Judy H.; Feldman, Marc (2015-7). "Heterogeneity of autoimmune diseases: pathophysiologic insights from genetics and implications for new therapies". Nature Medicine. 21 (7): 730–738. doi:10.1038/nm.3897. ISSN 1546-170X. PMC 5716342 . PMID 26121193. Diarsipkan dari versi asli tanggal 2019-02-01. Diakses tanggal 2019-01-31.
- ^ Uzzaman A, Cho SH (2012). "Chapter 28: Classification of hypersensitivity reactions". Allergy Asthma Proc. Suppl 1: 96–99. PMID 22794701.
- ^ a b Taylor A, Watson C, Bradley J (2005). "Immunosuppressive agents in solid organ transplantation: Mechanisms of action and therapeutic efficacy". Crit Rev Oncol Hematol. 56 (1): 23–46. PMID 16039869.
- ^ Barnes P (2006). "Corticosteroids: the drugs to beat". Eur J Pharmacol. 533 (1–3): 2–14. PMID 16436275.
- ^ Masri M (2003). "The mosaic of immunosuppressive drugs". Mol Immunol. 39 (17–18): 1073–7. PMID 12835079.
- ^ Spelman, K (2006). "Modulation of cytokine expression by traditional medicines: a review of herbal immunomodulators". Alternative Medicine reviews: 128–150. PMID 16813462.
- ^ Brush, J (2006). "The effect of Echinacea purpurea, Astragalus membranaceus and Glycyrrhiza glabra on CD69 expression and immune cell activation in humans". Phytotherapy Research. 20: 687–695. PMID 16807880.
- ^ Morgan R; et al. (2006). "Cancer regression in patients after transfer of genetically engineered lymphocytes". Science. 314: 126–129. PMID 16946036.
- ^ a b Andersen MH, Schrama D, Thor Straten P, Becker JC (2006). "Cytotoxic T cells". J Invest Dermatol. 126 (1): 32–41. PMID 16417215.
- ^ Boon T, van der Bruggen P (1996). "Human tumor antigens recognized by T lymphocytes". J Exp Med. 183: 725–29. PMID 8642276.
- ^ Castelli C, Rivoltini L, Andreola G, Carrabba M, Renkvist N, Parmiani G (2000). "T cell recognition of melanoma-associated antigens". J Cell Physiol. 182: 323–31. PMID 10653598.
- ^ a b Romero P, Cerottini JC, Speiser DE (2006). "The human T cell response to melanoma antigens". Adv Immunol. 92: 187–224. PMID 17145305.
- ^ a b Guevara-Patino JA, Turk MJ, Wolchok JD, Houghton AN (2003). "Immunity to cancer through immune recognition of altered self: studies with melanoma". Adv Cancer Res. 90: 157–77. PMID 14710950.
- ^ Renkvist N, Castelli C, Robbins PF, Parmiani G (2001). "A listing of human tumor antigens recognized by T cells". Cancer Immunol Immunother. 50: 3–15. PMID 11315507.
- ^ Gerloni M, Zanetti M. (2005). "CD4 T cells in tumor immunity". . Springer Semin Immunopathol. 27 (1): 37–48. PMID 15965712.
- ^ a b Seliger B, Ritz U, Ferrone S (2006). "Molecular mechanisms of HLA class I antigen abnormalities following viral infection and transformation". Int J Cancer. 118 (1): 129–38. PMID 16003759.
- ^ Hayakawa Y, Smyth MJ. (2006). "Innate immune recognition and suppression of tumors". Adv Cancer Res. 95: 293–322. PMID 16860661.
- ^ Poh, Ashleigh R.; Ernst, Matthias (2018). "Targeting Macrophages in Cancer: From Bench to Bedside". Frontiers in Oncology. 8: 49. doi:10.3389/fonc.2018.00049. ISSN 2234-943X. PMC 5858529 . PMID 29594035. Diarsipkan dari versi asli tanggal 2019-02-01. Diakses tanggal 2019-01-31.
- ^ a b c Syn, Nicholas L; Teng, Michele W L; Mok, Tony S K; Soo, Ross A (2017). "De-novo and acquired resistance to immune checkpoint targeting". The Lancet Oncology (dalam bahasa Inggris). 18 (12): e731–e741. doi:10.1016/s1470-2045(17)30607-1. Diarsipkan dari versi asli tanggal 2019-05-14. Diakses tanggal 2019-01-13.
- ^ a b Seliger B (2005). "Strategies of tumor immune evasion". BioDrugs. 19 (6): 347–54. PMID 16392887.
- ^ Frumento G, Piazza T, Di Carlo E, Ferrini S (2006). "Targeting tumor-related immunosuppression for cancer immunotherapy". Endocr Metab Immune Disord Drug Targets. 6 (3): 233–7. PMID 17017974.
- ^ MacLeod, Megan K. L.; Kappler, John W.; Marrack, Philippa (2010-5). "Memory CD4 T cells: generation, reactivation and re-assignment". Immunology. 130 (1): 10–15. doi:10.1111/j.1365-2567.2010.03260.x. ISSN 1365-2567. PMC 2855788 . PMID 20331469. Diarsipkan dari versi asli tanggal 2019-01-25. Diakses tanggal 2019-01-25.
- ^ Singh M, O'Hagan D (1999). "Advances in vaccine adjuvants". Nat Biotechnol. 17 (11): 1075–81. PMID 10545912.
- ^ Krishna, Murli; Nadler, Steven G. (2016). "Immunogenicity to Biotherapeutics - The Role of Anti-drug Immune Complexes". Frontiers in Immunology. 7: 21. doi:10.3389/fimmu.2016.00021. ISSN 1664-3224. PMC 4735944 . PMID 26870037. Diarsipkan dari versi asli tanggal 2019-01-21. Diakses tanggal 2019-01-21.
- ^ Hodge, James W.; Garnett, Charlie T.; Farsaci, Benedetto; Palena, Claudia; Tsang, Kwong-Yok; Ferrone, Soldano; Gameiro, Sofia R. (2013-08-01). "Chemotherapy-induced immunogenic modulation of tumor cells enhances killing by cytotoxic T lymphocytes and is distinct from immunogenic cell death". International Journal of Cancer. 133 (3): 624–636. doi:10.1002/ijc.28070. ISSN 1097-0215. PMC 3663913 . PMID 23364915. Diarsipkan dari versi asli tanggal 2019-01-25. Diakses tanggal 2019-01-25.
- ^ Pfirschke, Christina; Engblom, Camilla; Rickelt, Steffen; Cortez-Retamozo, Virna; Garris, Christopher; Pucci, Ferdinando; Yamazaki, Takahiro; Poirier-Colame, Vichnou; Newton, Andita (2016-02-16). "Immunogenic Chemotherapy Sensitizes Tumors to Checkpoint Blockade Therapy". Immunity. 44 (2): 343–354. doi:10.1016/j.immuni.2015.11.024. ISSN 1097-4180. PMC 4758865 . PMID 26872698. Diarsipkan dari versi asli tanggal 2019-01-25. Diakses tanggal 2019-01-25.
- ^ Welling GW, Wiejer WJ, van der Zee R, Welling-Werster S. (1985). "Prediction of sequential antigenic regions in proteins". J Mol Recognit. 88 (2): 215–8. PMID 2411595.
- ^ Sollner J, Mayer B. (2006). "Machine learning approaches for prediction of linear B-cell epitopes on proteins". 19 (3): 200–8. PMID 16598694.
- ^ Saha S, Bhasin M, Raghava GP. (2005). "Bcipep: a database of B-cell epitopes". BMC Bioinformatics. 6 (1): 79. PMID 15921533.
- ^ Flower DR, Doytchinova IA. (2002). "Immunoinformatics and the prediction of immunogenicity". Appl Bioinformatics. 1 (4): 167–76. PMID 15130835.
- ^ a b Beck, Gregory (November 1996). "Immunity and the Invertebrates" (PDF). Scientific American: 60–66. Diarsipkan (PDF) dari versi asli tanggal 2009-03-04. Diakses tanggal 2007-01-01.
- ^ Bickle T, Krüger D (1993). "Biology of DNA restriction". Microbiol Rev. 57 (2): 434–50. PMID 8336674.
- ^ Barrangou R, Fremaux C, Deveau H, Richards M, Boyaval P, Moineau S, Romero DA, Horvath P (Mar 2007). "CRISPR provides acquired resistance against viruses in prokaryotes". Science. 315 (5819): 1709–12. Bibcode:2007Sci...315.1709B. doi:10.1126/science.1138140. PMID 17379808.
- ^ Brouns SJ, Jore MM, Lundgren M, Westra ER, Slijkhuis RJ, Snijders AP, Dickman MJ, Makarova KS, Koonin EV, van der Oost J (Aug 2008). "Small CRISPR RNAs guide antiviral defense in prokaryotes". Science. 321 (5891): 960–4. Bibcode:2008Sci...321..960B. doi:10.1126/science.1159689. PMC 5898235 . PMID 18703739.
- ^ Bayne CJ (2003). "Origins and evolutionary relationships between the innate and adaptive arms of immune systems". Integr. Comp. Biol. 43 (2): 293–299. doi:10.1093/icb/43.2.293. PMID 21680436.
- ^ Stram Y, Kuzntzova L. (2006). "Inhibition of viruses by RNA interference". Virus Genes. 32 (3): 299–306. PMID 16732482.
- ^ Jones JD, Dangl JL (2006). "The plant immune system". Nature. 444 (7117): 323–9. Bibcode:2006Natur.444..323J. doi:10.1038/nature05286. PMID 17108957.
- ^ Durrant WE, Dong X (2004). "Systemic acquired resistance". Annu Rev Phytopathol. 42: 185–209. PMID 15283665.
- ^ Baulcombe D (2004). "RNA silencing in plants". Nature. 431 (7006): 356–63. PMID 15372043.
- ^ M.N. Alder, I.B. Rogozin, L.M. Iyer, G.V. Glazko, M.D. Cooper, Z. Pancer (2005). "Diversity and Function of Adaptive Immune Receptors in a Jawless Vertebrate". Science. 310 (5756): 1970–1973. PMID 16373579.
- ^ a b Finlay B, McFadden G (2006). "Anti-immunology: evasion of the host immune system by bacterial and viral pathogens". Cell. 124 (4): 767–82. PMID 16497587.
- ^ Cianciotto NP. (2005). "Type II secretion: a protein secretion system for all seasons". Trends Microbiol. 13 (12): 581–8. PMID 16216510.
- ^ Winstanley C, Hart CA (2001). "Type III secretion systems and pathogenicity islands". J Med Microbiol. 50 (2): 116–26. PMID 11211218.
- ^ Finlay B, Falkow S (1997). "Common themes in microbial pathogenicity revisited" (PDF). Microbiol Mol Biol Rev. 61 (2): 136–69. PMID 9184008. Diarsipkan (PDF) dari versi asli tanggal 2009-03-04. Diakses tanggal 2007-11-09.
- ^ Kobayashi H (2005). "Airway biofilms: implications for pathogenesis and therapy of respiratory tract infections". Treat Respir Med. 4 (4): 241–53. PMID 16086598.
- ^ Housden N, Harrison S, Roberts S, Beckingham J, Graille M, Stura E, Gore M (2003). "Immunoglobulin-binding domains: Protein L from Peptostreptococcus magnus" (PDF). Biochem Soc Trans. 31 (Pt 3): 716–8. PMID 12773190.
- ^ Burton, Dennis R. (2005). "Antibody vs. HIV in a clash of evolutionary titans". Proc Natl Acad Sci U S A. 102 (42): 14943–8. PMID 16219699.
- ^ Taylor JE, Rudenko G (Nov 2006). "Switching trypanosome coats: what's in the wardrobe?". Trends in Genetics. 22 (11): 614–20. doi:10.1016/j.tig.2006.08.003. PMID 16908087.
- ^ Cantin R, Methot S, Tremblay MJ. (2005). "Plunder and stowaways: incorporation of cellular proteins by enveloped viruses". J Virol. 79 (11): 6577–87. PMID 15890896.
Pranala luar
- Bagaimana Imunitasmu bekerja dari How Stuff Works
- Imunitas Diarsipkan 2007-01-01 di Wayback Machine. dari Universitas Hartford
- Buku elektronik Imunobiologi edisi kelima (ISBN 0-8153-3642-X), oleh Charles Janeway, et al.
- Imunologi dari jurnal ilmu pengetahuan Pusat BioMed
- Kehidupan dalam sel Diarsipkan 2008-04-22 di Wayback Machine. - Fungsi dalam tubuh manusia
- Dunia mikroba, pertahanan binatang terhadap mikroba Diarsipkan 2008-05-01 di Wayback Machine. - bahasan dalam buku elektronik mikrobiologi
- Imunitas tanaman Diarsipkan 2007-09-30 di Wayback Machine. - Institut Patologi Tanaman Biokimia di Pusat Penelitian GSF-National untuk lingkungan dan kesehatan
